背景介紹
互作轉錄組測序技術Dual RNA-seq,是研究宿主和微生物互作的技術,無需分離物種,一次實驗同時分析兩個或多個互作物種間基因表達的動態變化,并通過互作模型圖獲得物種間基因的調控關系,得到物種間相互作用的機制。
最初互作轉錄組測序技術主要應用于一些疾病研究上如感染性肺炎、炎癥性腸病、齲齒、牙周炎等常見慢性感染性疾病上。后來,互作轉錄組延伸到腸道、呼吸道、皮膚、口腔微生物等研究,從單純的原核微生物到后來的真核微生物互作。再之后,植物-微生物互作也被廣泛研究。
技術路線
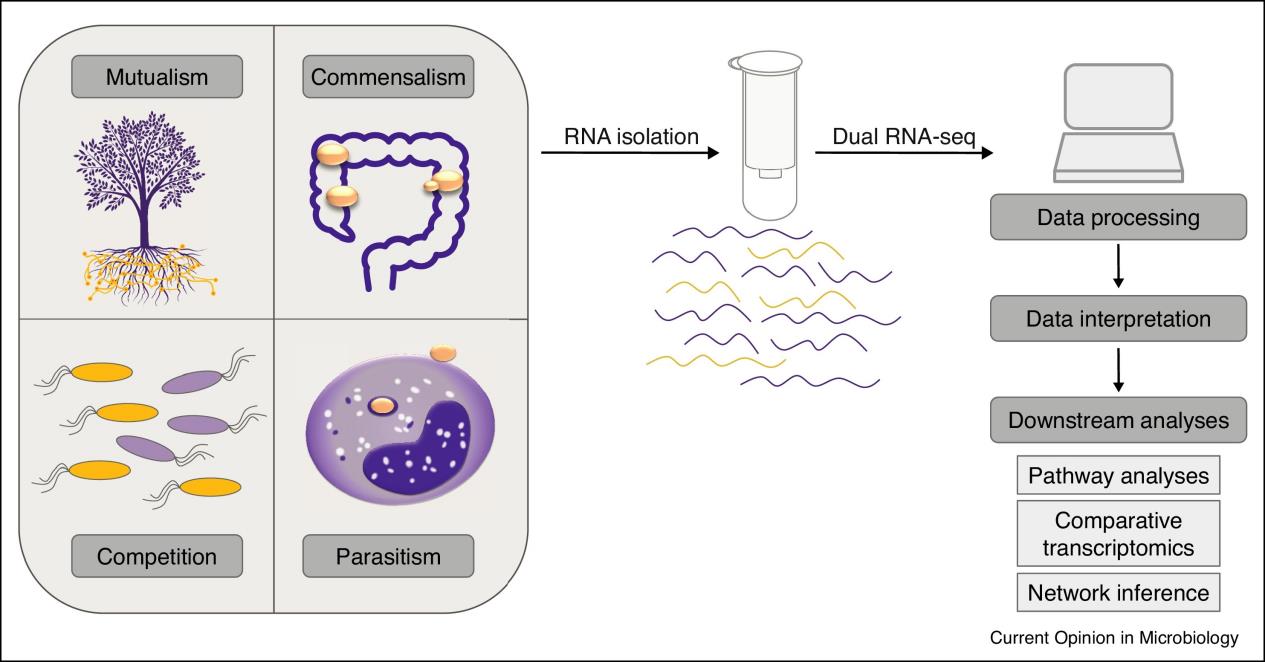
圖.Dual RNA-seq實驗流程:W.T. et. al,2017
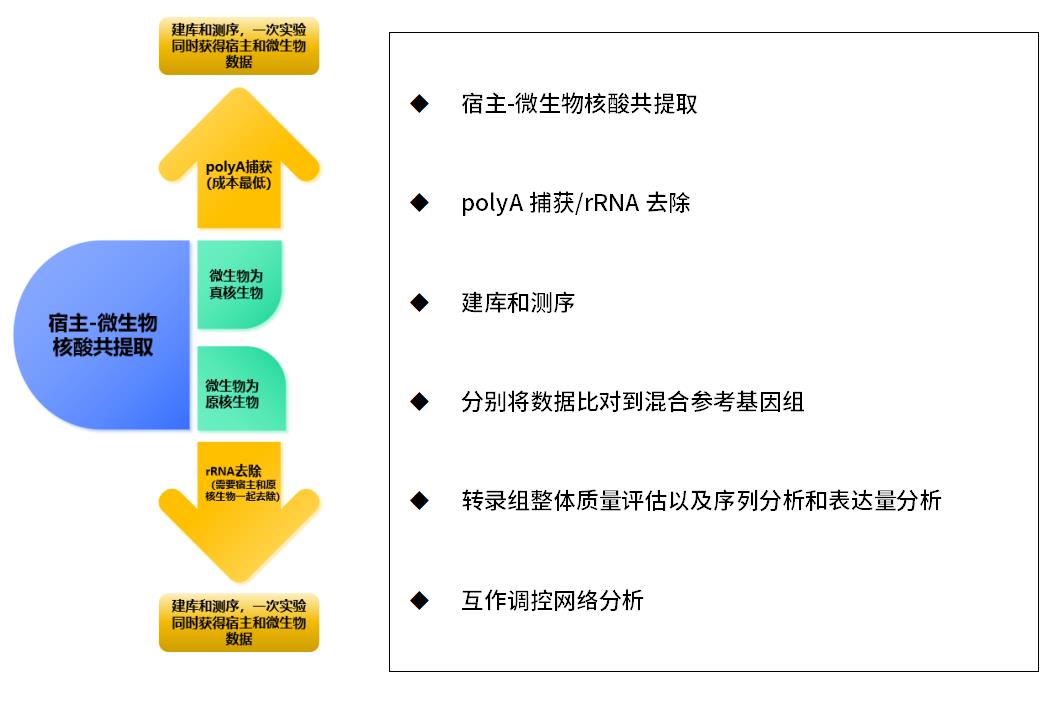
技術應用
醫學領域
研究病原體致病機制;
探索宿主免疫應答機制。
農業領域
動植物病蟲害防治;
生物共生關系研究。
實驗方案
步驟 | 產品推薦 | 產品貨號 |
宿主-微生物共提取 | MolPure® Magnetic Pathogen DNA/RNA Kit 磁珠法病原DNA/RNA提取試劑盒 | 18306ES |
gDNA消化 | Deoxyribonuclease I (DNase I) from bovine pancreas | 10607ES |
rRNA去除或者polyA捕獲 | 磁珠法微生物核糖體去除盒+磁珠法被子植物核糖體去除試劑盒 (植物-微生物互作) 或 磁珠法哺乳動物通用核糖體去除試劑盒+磁珠法原核微生物核糖體去除試劑盒(動物-微生物互作) | 12262ES+12264ES或12266ES+12264ES |
Hieff NGS® mRNA Isolation Master Kit V2 (polyA 捕獲,適合互作微生物為真菌) | 12629ES | |
total RNA建庫 | Hieff NGS ® EvoMax RNA Library Prep Kit(dUTP) | 12340ES |
測序 | Illumina或者MGI | |
建議實驗時,選擇帶UMI標簽的接頭,如13370ES~13371ES(Illumina)/13367ES~13368ES(MGI) | ||
(該實驗方案參考文獻編寫)
要點強調:
Dual RNA-seq的關鍵點有兩個,一個是樣本的選擇,需要取到被感染到的樣本,但是取到了被感染的樣本,寄生微生物的量也很有可能比較低比如取被寄生的植物葉片或根莖,提取 RNA,那么絕大部分都是植物的 RNA、取動物組織,提取 RNA,那么絕大部分還是被感染動物的 RNA等情況。 二是生信分析,dual RNA-seq生信分析時,需要有感染前后的差異比較以及差異基因是否參與了互作影響的精細分析。
參考文獻:
1、Westermann A J, Barquist L, Vogel J. Resolving host-pathogen interactions by dual RNA-seq[J]. Plos Pathogens, 2017, 13(2):e1006033.
2、Wolf T, K?mmer P, Brunke S, et al. Two's company: studying interspecies relationships with dual RNA-seq[J]. Current Opinion in Microbiology, 2017, 42:7.
3、Marsh JW, Humphrys MS, Myers GSA. A Laboratory Methodology for Dual RNA-Sequencing of Bacteria and their Host Cells In Vitro. Front Microbiol. 2017 Sep 21;8:1830.
相關產品
免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號

















 采購中心
采購中心