
研究團隊首先合成了DOX-TPP@ZIF-67 NPs。首先,將硝酸鈷和2-甲基咪唑在水中反應,形成紫色的ZIF-67納米顆粒。然后將帶有三苯基膦(TPP)的DOX溶于水中,加入到ZIF-67中,利用其孔結構和表面電荷吸附藥物,在pH約6.5–7的條件下反應72小時,獲得中空結構的DOX-TPP@ZIF-67 NPs。TEM和SEM圖像顯示顆粒約為210 nm;N?吸附-脫附測試顯示具有介孔結構,表明藥物已裝載;裝藥后比表面積與孔體積略有降低,驗證了載藥效果;BJH分析顯示孔徑集中在約2 nm和60 nm。ZIF-67的鈷離子中心具有催化分解H?O?的功能,可使納米粒子在富含H?O?的環境中實現推進;在不同濃度H?O?中觀察到粒子運動軌跡增強、擴散速率增快、均方位移(MSD)升高;表明其可作為“納米馬達”,在腫瘤等富H?O?微環境中增強藥物富集。藥物釋放在酸性環境(pH 5.5)和高H?O?濃度下顯著加快;表明其具有pH和H?O?響應性,適合于腫瘤微環境中的靶向藥物釋放 (圖1)。

圖1. 表征,藥物裝載,和空心DOX-TPP@ZIF-67 NPs和NPs運動的藥物釋放譜。(A)中空DOX-TPP@ZIF-67 NPs的制備流程圖。(B) ZIF-67 NPs和空心DOX-TPP@ZIF-67 NPs的透射電鏡(TEM)和(C?D)掃描電鏡(SEM)圖像。三張單獨的TEM圖像被包括在內,以呈現不同的視角和不同程度的結構破壞(D)。(E) ZIF-67 NPs和空心DOXTPP@ZIF-67 NPs的BET分析。(F)在不同H2O2濃度的PBS溶液中,ZIF-67@DOX-TPP NPs在2 s內的代表性軌跡。(G)速度測量以mean±SEM表示,n = 15。(H)中空DOX-TPP@ZIF-67 NPs的均方位移(MSD)分析。(I?J)不同pH條件(I)和不同H2O2濃度(J)下NPs中DOX-TPP的累積釋放量(n = 3;平均值±SEM)。所有柱狀圖表示均數±SEM, n = 3個獨立實驗,采用單因素方差分析和Tukey多重比較檢驗來評估組間的統計學顯著性。P值如圖所示。
該微針陣列是利用摩方精密microArch® S240 (精度:10 μm)3D打印設備加工模具后經PDMS翻模制備而成的。首先將藥物負載的納米顆粒(DOX-TPP@ZIF-67 NPs)與PVA/蔗糖基質混合,涂覆到PDMS模具中以形成可溶性微針;然后通過第二次澆鑄聚苯乙烯(PS)形成微針背板層。微針陣列為10×10排列,每根針的高度為850 μm,針底直徑為400 μm,針間距為700 μm;PVA/蔗糖用于制針頭,因其良好的機械性和水溶性;PS用于背板,增強化學穩定性并降低成本;元素分布圖顯示微針中C、O、Co分布均勻,掃描區域中P含量為0.33%,證明藥物負載成功。力學測試顯示每根微針可承受最高0.62 N壓力,足以穿透皮膚。在豬皮膚外植體測試中,微針可在表皮留下均勻孔洞,表現出良好的穿透性能;冷凍切片分析顯示藥物能夠有效穿透皮膚層;OCT成像證實微針可穿透皮膚至少300 μm深度,進一步驗證其優異的透皮遞送能力。所構建的HDT-Z@MNs結構合理、力學性能良好,藥物成功集中裝載于針尖,在豬皮模型中表現出優異的穿透力和藥物輸送效率,為腫瘤局部治療提供了可靠的經皮給藥平臺(圖2)。

圖2. 中空DOX-TPP@ZIF-67納米顆粒負載納米顆粒的表征(HDT-Z@MNs)。(A) HDT-Z@MNs制備模式圖。(B) HDT-Z@MNs的代表性光學顯微鏡圖像。(C)掃描電鏡圖像的HDT-Z@MNs陣列與一個單一的MN在最右邊。(D-E)單個MN的SEM截面圖,(D) MN尖部截面積中C、O、Co的元素分布,以及尖部截面積的EDS點分析圖(E)。(F) HDT-Z@MNs的力-位移曲線。(G-H) HDT-Z@MNs穿刺離體豬皮的代表性明場顯微鏡圖像(G)和光學相關斷層掃描結構圖像(H)。
藥物載體通過能量依賴性胞吞被細胞內吞,首先定位于內體,隨后轉運至溶酶體釋放藥物,藥物最終進入胞質并向線粒體靶向遞送;TEM圖像確認納米粒子被細胞攝取,并定位于溶酶體中;TPP?是一種疏水陽離子,易在線粒體負膜電位驅動下富集在線粒體;在MCF-7/DOX細胞中共孵育2、4、8、12小時,觀察DOX與線粒體共定位;共定位率隨時間增加,12小時時HDT-Z@MNs組最高(0.71),明顯優于:D@MNs(自由DOX@MNs);DT@MNs(DOX-TPP@MNs);HD-Z@MNs(中空DOX@ZIF-67 MNs)優勢歸因于:ZIF-67提供的載體結構與運動能力;TPP?賦予的線粒體靶向特性。HDT-Z@MNs通過納米馬達運動性與TPP?介導的線粒體靶向雙重機制,實現高效胞內遞送與線粒體定位,尤其在DOX耐藥乳腺癌細胞中顯示出增強的細胞攝取與線粒體富集能力,為耐藥性乳腺癌治療提供了新的策略和突破點(圖3)。

圖3. 中空DOX-TPP@ZIF-67的細胞內攝取和線粒體靶向。(A)腫瘤細胞內NPs運動示意圖。(B-C)經HDT-Z@MNs處理2、4、8和12小時的MCF-7/DOX細胞。細胞核和線粒體分別用Hoechst 33342(藍色)和Mtio-Tracker Green染料染色,共聚焦顯微鏡觀察線粒體和NPs共定位圖像(B), (C)柱狀圖中顯示的共定位比代表使用ImageJ中的Coloc2插件計算的Manders '重疊系數(MOC)。(D)對經HDT-Z@MNs處理12 h的MCF-7/DOX細胞進行超薄切片,透射電鏡觀察細胞對DOX/DOX-TPP的攝取過程。(E)分別在MCF-7/DOX細胞中孵育12 h后,D@MNs、DT@MNs、HD-Z@MNs和HDT-Z@MNs與線粒體共定位的熒光圖像。細胞核用Hoechst 33342染色(藍色),線粒體用Mito-Tracker Green FM標記(綠色)。紅色熒光表示DOX或DOX-TPP。右邊的白色熒光表示與線粒體共定位的部分,最右邊的列表示MCF-7/DOX細胞質溶膠中計算出的線粒體和DOX共定位的比例。共定位比用Manders系數表示,使用ImageJ中的Coloc2插件計算。所有柱狀圖表示均數±標準差,n = 3個獨立實驗,采用單因素方差分析后采用Tukey多重比較檢驗來評估組間的統計學顯著性。P值如圖所示。
細胞存活實驗顯示:在2、4、8 μg/mL濃度下,HDT-Z@MNs對MCF-7/DOX細胞具有強毒性,IC50為4 μg/mL,優于其他對照組;克隆形成實驗進一步表明,HDT-Z@MNs處理后,MCF-7/DOX細胞的克隆顯著減少,且結構松散;Live/dead染色顯示HDT-Z@MNs對細胞均具明顯毒性。劃痕實驗評估細胞遷移:HDT-Z@MNs處理后,MCF-7/DOX細胞的傷口閉合率僅20.1%;在含Matrigel的模型中,HDT-Z@MNs組細胞侵襲能力低;表明該系統顯著抑制乳腺癌細胞遷移和侵襲能力。HDT-Z@MNs通過線粒體靶向遞藥,有效增強阿霉素敏感與耐藥乳腺癌細胞的線粒體損傷與凋亡,顯著抑制腫瘤細胞的增殖、遷移和侵襲能力。這為抗癌與抗轉移治療提供了一種高效且精準的化療策略,尤其在耐藥性乳腺癌治療中展現出突破性潛力(圖4)。
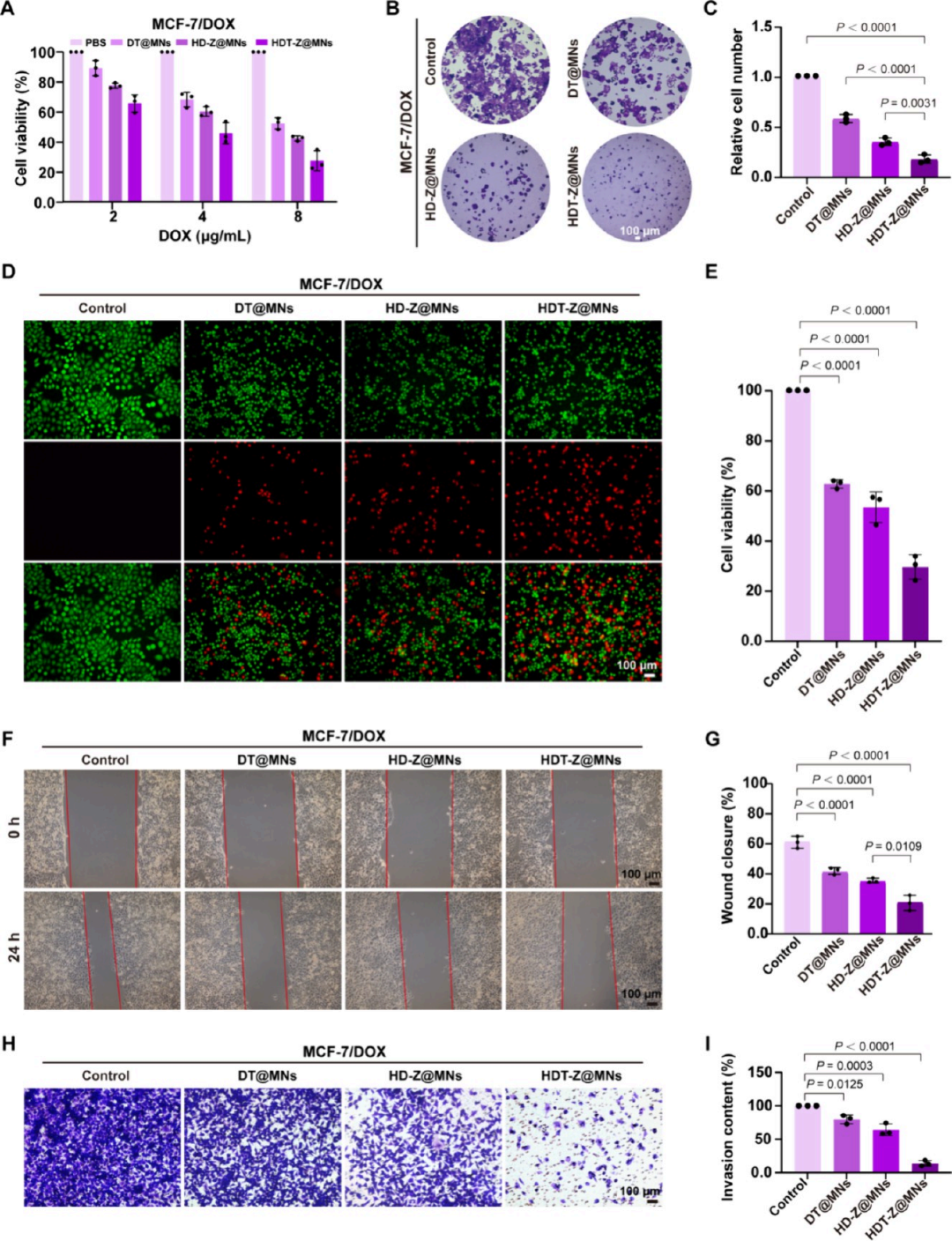
圖4. HDT-Z@MNs對癌細胞死亡和抑制轉移的體外評價。(A) MCF-7/DOX細胞與HDT-Z@MNs等孵育48小時后的細胞活力。(B)平板克隆實驗中MCF-7/DOX細胞經HDT-Z@MNs等處理后形成的細胞簇圖像和(C)細胞簇率。(D)不同處理后MCF-7/DOX細胞的活/死染色。DOX濃度在所有組中一致。綠色熒光(Calcein-AM)表示活細胞,紅色熒光(碘化丙啶,PI)表示死細胞,(E)表示細胞存活率。光學圖像顯示體外傷口愈合試驗和(F)相應的傷口愈合百分比。MCF-7/DOX細胞貼壁后(0 h)通過繪制均勻的細胞間隙建立傷口(G)。HDT-Z@MNs等與細胞共孵育24小時后檢測傷口愈合百分比(E)。(h)不同MN貼片處理后MCF-7/DOX細胞穿過Matrigel屏障的代表性圖像,以及(I)所示侵襲率的量化。所有柱狀圖表示均數±標準差,n = 3個獨立實驗,采用單因素方差分析后采用Tukey多重比較檢驗來評估組間的統計學顯著性。P值如圖所示。
全程小鼠體重穩定,提示整體治療方案安全性良好。抗腫瘤療效顯著(MCF-7/DOX 和 MCF-7模型):MCF-7/DOX小鼠模型中,HDT-Z@MNs組腫瘤抑制明顯,治療21天后腫瘤體積為初始的1倍以內,優于DT@MNs與HD-Z@MNs;腫瘤重量最小,且組織成像顯示藥物精確遞送至腫瘤組織內部至少100 μm;生存期延長顯著:60%小鼠生存超48天,而對照組31天內全部死亡;誘導凋亡, HDT-Z@MNs誘導細胞壞死/凋亡,并抑制增殖; HDT-Z@MNs能提高上皮標志物E-cadherin表達,降低N-cadherin和Vimentin表達,提示其有效抑制EMT過程,具有抗轉移潛力。組織病理學分析表明主要器官未見明顯損傷,表明全身毒性可控(圖5)。HDT-Z@MNs在阿霉素敏感與耐藥性乳腺癌模型中表現出顯著的腫瘤抑制、延長生存、抑制轉移及良好的安全性,為耐藥性腫瘤提供了一種有前景的線粒體靶向化療策略。后續研究應著重于多次給藥、聯合治療策略以及與傳統給藥方式的系統比較。

圖5. 在皮下耐藥乳腺癌模型中評估HDT-Z@MNs的體內抗腫瘤功效。(A)皮下接種MCF-7/DOX腫瘤小鼠模型示意圖及后續治療方案。局部腫瘤以對照、Z@MNs、DT@MNs、HD-Z@MNs或HDT-Z@MNs的方式給予,小鼠在治療期間的體重變化(B)、生存周期(C)和腫瘤生長動力學(D)進行治療(n = 5;平均值±SEM)。采用log-rank檢驗評估組間生存周期有無統計學意義。(F) HDT-Z@MNs穿刺腫瘤部位后的冰凍切片圖像,右側為腫瘤部位藥物釋放的放大和熒光。HDT-Z@MNs和其他對照小鼠治療過程中腫瘤生長變化圖像(G)、治療結束時切除腫瘤圖像(H)和(E)切除腫瘤重量(n = 5;平均值±SEM)。(I) HDT-Z@MNs及其他對照小鼠治療結束時切除腫瘤組織末端脫氧核苷酸轉移酶介導的三磷酸脫氧尿苷缺口末端標記(TUNEL)、Ki67和H&E染色的代表性圖像。(D和E)采用單因素方差分析,并采用Tukey多重比較檢驗來評估組間的統計學顯著性。P值如圖所示。
對MCF-7和MCF-7/DOX細胞(未處理及HDT-Z@MNs處理)進行定量能量代謝分析與廣泛靶向脂質代謝組學分析;主成分分析(PCA)顯示四組代謝輪廓顯著分離,共鑒定出692種代謝物差異;PC、PE、PS和TG是主要的脂質亞類成分;代謝通路富集分析表明HDT-Z@MNs可激活與細胞死亡密切相關的脂質代謝通路;能量代謝分析揭示其誘導碳代謝、核苷酸代謝、TCA循環等關鍵通路的重構。磷酸乙醇胺積累導致線粒體膜完整性破壞:磷酸乙醇胺是合成PE的重要中間體,其水平升高可影響線粒體膜脂組成,破壞外膜結構,從而觸發線粒體介導的細胞凋亡;在TPP修飾的線粒體靶向藥物DOX-TPP存在下,這種損傷進一步加劇。HDT-Z@MNs處理后,Bax(促凋亡)上調、Bcl-2(抗凋亡)下調,導致線粒體外膜通透性增加;隨后細胞色素c釋放,誘導Caspase級聯反應,激活Caspase-3裂解;同時,流式細胞術顯示HDT-Z@MNs誘導的晚期凋亡水平是其他對照組的1.5~4倍(圖6)。HDT-Z@MNs通過精準遞送DOX-TPP至線粒體,結合脂質代謝異常與能量通路重編程,高效誘導線粒體介導的凋亡,為解決耐藥性乳腺癌提供了靶向性強、機制明確的治療新策略,進一步驗證了線粒體靶向藥物遞送系統在克服腫瘤耐藥中的特別優勢。

圖6. 耐藥乳腺癌細胞凋亡的調控及其在抗癌治療中的作用。(A)每組樣品質譜數據的PCA評分圖。(B)圓形圖描繪了MCF-7/DOX細胞與HDT-Z@MNs處理24小時的MCF-7細胞和對照樣品相比的脂質亞類組成。(C)柱狀圖顯示不同能量代謝物的KEGG通路聚類。(D)差異表達的脂質代謝物的KEGG分類。(E)說明磷酸乙醇胺差異表達的小提琴圖。(F)在HDT-Z@MNs和相關對照條件下處理MCF-7/DOX細胞時,參與線粒體介導凋亡的關鍵蛋白的Western blot分析。采用雙因素方差分析和Sidak多重比較檢驗評估統計學顯著性。(G)灰度值量化(n = 3;(H)對MCF-7/DOX細胞進行處理后Annexin V-FITC/PI凋亡分析,并采用流式細胞術門控策略。代表性圖像來自三個獨立的生物重復(n = 3)。Q1,機械損傷死細胞;Q2,晚期凋亡細胞;Q3,對應早期凋亡細胞;Q4,表示活細胞。采用單因素方差分析和Tukey事后檢驗評估統計學顯著性。P值如圖所示。
總結:這項研究不僅展示了微針系統的高度可控性與安全性,也提出了以線粒體為新興靶點的多重協同治療策略,為乳腺癌及其他耐藥性實體瘤的臨床治療提供了新方向。
免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號




















 采購中心
采購中心