蛋白純化是蛋白研究的重要部分。蛋白質功能性、結構和相互作用的研究在很大程度上視已分離感興趣蛋白的純度和質量而定。在這里,我們向您介紹可幫您滿足需求的五步法實驗流程。了解蛋白表達、蛋白提取和保存、蛋白純化、蛋白除雜和蛋白定量及檢測的方法和技術。

蛋白純化實驗步驟
步驟一:蛋白表達-選擇適合您生產需求的表達系統
要生產用于早期發現研究(一直到大規模生產生物治療藥物)、疫苗研發和結構研究的重組蛋白,研究人員有多種方法可以選擇。必須針對感興趣的靶蛋白和應用使用正確的蛋白表達系統。我們提供眾多出色的哺乳動物、昆蟲、細菌和酵母菌蛋白表達系統以滿足您的研究需求。
我們的 Gibco Expi 瞬時表達系統采用哺乳動物(CHO-S、293F 細胞)和昆蟲(Sf9 細胞)表達形式,是經過優化的系統,可快速、高產量地生產蛋白。


ExpiCHO 和其他瞬時 CHO 表達系統中的重組蛋白滴度。所示為人 IgG、兔 IgG 和促紅細胞生成素在 ExpiCHO 和其他瞬時 CHO 表達系統中的表達水平。ExpiCHO 滴度是其他瞬時 CHO 表達系統的 25–160 倍。
產品推薦
ExpiCHO 表達系統:Gibco ExpiCHO 表達系統是一款經優化的完整系統,由 ExpiCHO-S(TM) 細胞組成,這些細胞在 ExpiCHO(TM) 表達培養基中可適應高密度、無血清的懸浮培養,再加上經特殊設計的轉染試劑和增強劑,可在瞬時系統中實現較高產量(多達 3g/L)。這意味著您可從 CHO 細胞開始研究工作,并在發現過程中始終使用 CHO 細胞。
Expi293 表達系統 :Gibco Expi293 表達系統是一款經優化的完整系統,由 Expi293(TM) 細胞組成,這些細胞在 Expi293(TM) 表達培養基中可適應高密度、無血清的懸浮培養,再加上經特殊設計的轉染試劑和增強劑,可在五到七天的短短時間內實現重組293來源的重組蛋白表達,蛋白產量是前幾代瞬時表達系統的 2-10 倍
ExpiSf 表達系統:ExpiSf 表達系統是化學成分確定的桿狀病毒昆蟲細胞蛋白表達系統,采用快速、簡化的工作流程,每次實驗都可達到高產量(蛋白超過3倍多)和出色的一致性。
小貼士
開始使用 Expi 瞬時表達系統時,請確保檢查以下事項:
? 檢查您的 DNA:260:280 比、260:230 比和轉染前的 DNA 濃度
? 檢查您的試劑儲存條件:4-8°C 且避光
? 檢查您的培養箱:確保顯示溫度、CO2% 和濕度是準確的,且分別為 37°C、8% 和 80%
? 檢查您的細胞:確保倍增時間、活力和細胞直徑均理想,可立即轉染
? 檢查您的體積:確保您的培養體積是對的:燒瓶尺寸比為 1:3.6(1:3 – 1:4 就可以)
? 檢查您的速度:增加體積會降低速度;減少體積會增加速度
蛋白表達產品

步驟二:蛋白提取和穩定-從樣本中提取并穩定您的靶蛋白
蛋白提取技術因原始材料的來源、感興趣蛋白在細胞內的位置以及下游應用而異。其他重要的考慮因素包括保持蛋白活性和功能以及降低背景影響。
蛋白提取
組織和細胞裂解
過去,人們使用機械破壞裂解細胞和組織;我們開發的溫和、去垢劑型解決方案旨在有效地裂解細胞并實現亞細胞結構的分離但無需物理破壞,實現活性蛋白的高產量。
蛋白提取產品的特點:
? 經過優化—配方較大程度地提高蛋白產量并保持蛋白活性
? 高效—僅亞細胞組分之間出現較少交叉污染
? 兼容—提取物可直接用于大多數下游應用
? 溫和—無需對大多數樣本類型進行機械細胞破壞
在多種哺乳動物細胞類型和細胞腔室中實現高蛋白產量

使用 M-PER 哺乳動物蛋白提取試劑從主要細胞腔室中提取蛋白的效率。使用 M-PER 試劑從規定細胞系和原代培養物制備裂解物并評估了從多種細胞腔室中提取的效率。對于各靶蛋白,加入 10 μg 裂解物以便通過 SDS PAGE 電泳、轉印到硝酸纖維素膜上并使用 SuperSignal West Pico PLUS 化學發光底物進行蛋白質免疫印跡檢測。

使用 M-PER 哺乳動物蛋白提取試劑從各種細胞類型中提取蛋白的產量。在匯合度為 85% 時收集細胞,清洗兩次并在冰浴的 PBS 中收集,然后計數。對于每種細胞類型,將 1 x 106細胞通過 2,000 x g 離心 5 分鐘進行沉淀,并在 1 mL M-PER 試劑中裂解 5 分鐘。通過以 14,000 x g 離心 10 分鐘澄清細胞裂解物,收集上清液并使用 Pierce BCA 蛋白定量試劑盒檢測蛋白濃度(µg/百萬細胞)
膜蛋白的高效選擇性富集

使用 Thermo Scientific Mem-PER Plus 膜蛋白提取試劑盒提高蛋白產量。使用 Thermo Scientific Mem-PER Plus 膜蛋白提取試劑盒及其他三種商用提取試劑盒從小鼠肝組織和 HeLa 細胞中分離膜蛋白。利用 Thermo Scientific Pierce BCA 蛋白定量試劑盒對膜、細胞質和總蛋白的產量 (μg) 進行測定。
從各種組織中高效提取蛋白

使用 T-PER 組織蛋白提取試劑提取組織細胞裂解蛋白的產量。對重復的組織樣品進行稱重,以1:10至1:20 w/v T-PER 試劑重新懸浮,并在冷凍的 Dounce 或臺式組織均質儀中破碎。在 10,000 x g 下離心所得裂解物5分鐘并收集上清液。通過 Pierce BCA 蛋白定量測定每種裂解物的蛋白濃度,從而確定每毫克起始組織的蛋白產量。
從細菌細胞中高效提取蛋白

兩種細菌細胞裂解試劑的蛋白產量比較。將大腸桿菌 ER2566/pLATE51-Klenow、ER2566/pGST-CC-StpB 和 ER2566/pGS-Syk 細胞沉淀物 (0.5 g) 重懸于 Thermo Scientific B-PER 全套細菌蛋白提取試劑或 EMD Chemicals BugBuster 預混液的 2.5 mL 等分試樣中,室溫下輕輕渦旋15分鐘。在 4°C 下以 16,000 x g 離心20分鐘,去除不溶性細胞碎片。使用 Pierce BCA 蛋白測定試劑盒 測定可溶性組分的蛋白產量(濃度)。

去垢劑溶液
去垢劑常用于細胞裂解試劑配方及其他蛋白研究方法。Thermo Scientific Surfact-Amps 去垢劑溶液采用高純度、預先精確稀釋 (10%) 的配方,非常適合用于對未純化去垢劑中的雜質敏感的應用或測定。
蛋白去垢劑產品特點:
· 精準——精確溶解于超純水中的10%去垢劑溶液
· 易用——溶液易于分配和進一步稀釋
· 高純度——過氧化物和碳基含量低于 1.0 μq/mL
· 穩定——在惰性氮氣條件下裝入玻璃安瓿或 HDPE 瓶中

去垢劑分子的一般結構。
蛋白穩定
細胞裂解時會破壞細胞膜和細胞器,導致酶活性不受調控,從而降低蛋白產量并影響蛋白功能。為了防止這些不利影響,需要向裂解試劑中加入蛋白酶和磷酸酶抑制劑。現已發現多種可以破壞或抑制蛋白酶和磷酸酶活性的化合物。
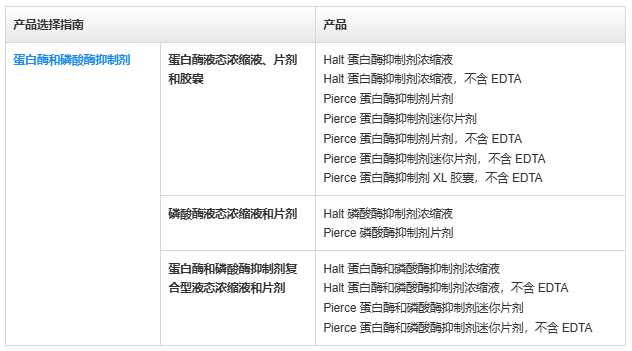
蛋白酶和磷酸酶抑制劑產品特點:
· 使用便捷——公開的即用型廣譜配方,提供濃縮液液、片劑或膠囊的形式,以及多種包裝規格,有效期至少為1年
· 全面保護——蛋白酶和磷酸酶抑制劑二合一配方,以液體和片劑的形式提供(含 EDTA 或不含 EDTA)
· 兼容——可搭配 Thermo Scientific Pierce 細胞裂解試劑及其他基于去垢劑的商用或自制裂解液使用
對蛋白酶和磷酸酶的廣泛有效抑制

三種市售蛋白酶抑制劑片劑的性能比較。在含或不含 EDTA 且分別添加了 Thermo Scientific Pierce 蛋白酶抑制劑迷你片劑、Roche™ Complete™ 蛋白酶抑制劑片劑、Sigma-Aldrich™ SIGMAFAST™ 蛋白酶抑制劑混合物片劑的情況下,胰腺提取物(100 μL;0.5 μg/μL)與猝滅的熒光胰蛋白酶、半胱氨酸、金屬蛋白酶和組織蛋白酶裂解底物一起孵育。37°C 下孵育1小時,并在相應的發射波長下測定熒光信號。圖片顯示了各種蛋白酶抑制劑配方的抑制效率。

Thermo Scientific 磷酸酶抑制劑迷你片劑大幅度保持了細胞提取物中的蛋白磷酸化。(A) 對 HCT116 細胞進行血清饑餓處理,用 EGF 刺激15分鐘,或留作對照細胞。在 Thermo Scientific Pierce IP 裂解緩沖液中,以 Thermo Scientific 蛋白酶和磷酸酶抑制劑迷你片劑、不含 EDTA 或者不使用抑制劑的情況下,制備細胞裂解物。將包含 500 μg 蛋白的裂解物與 5 μg 磷酸酪氨酸抗體在 4oC 下孵育過夜。然后將抗體復合物與 Thermo Scientific Pierce 蛋白 A/G 磁珠在室溫下孵育1小時。漂洗磁珠并在低 pH 值下洗脫。洗脫物通過蛋白免疫印跡進行檢測,使用 EGFR 抗體檢測膜后進行化學發光檢測。(B)在分別添加 Pierce 磷酸酶抑制劑迷你片劑、Roche™ PhosStop™ 磷酸酶抑制劑片劑以及 Sigma-Aldrich™ 磷酸酶抑制劑混合液2和3的配方情況下,通過將提取物與可測量磷酸酶活性的熒光底物(MFP 或 FDP)一起孵育,從而測定腎臟提取物(25μL;0.5 μg/μL)中對蛋白磷酸酶、堿性磷酸酶和酸性磷酸酶活性的抑制程度。37°C 下孵育1小時,并在相應的發射波長下測定熒光信號。圖片顯示了各種磷酸酶抑制劑配方的抑制效率。
小貼士
· 細胞裂解時會破壞細胞膜和細胞器,導致蛋白水解活性不受調控,從而降低蛋白產量并影響蛋白功能。為了防止提取的蛋白降解,通常需要在細胞裂解試劑中添加蛋白酶和磷酸酶抑制劑。
· 大多數研究人員會使用幾種不同抑制劑的混合物,以確保蛋白提取物在感興趣靶標分析之前不被降解。蛋白酶抑制劑基本在所有蛋白提取中都需要使用,而磷酸酶抑制劑僅在研究磷酸化狀態時才需要使用。
· 通過 SDS-PAGE 分析溶解蛋白和不溶性組分樣品,可測定所用蛋白提取方法的效率。
蛋白提取和蛋白酶抑制劑產品選擇指南
組織和細胞裂解

用于溶解蛋白的去垢劑

蛋白酶和磷酸酶抑制劑
步驟三:蛋白純化-純化和富集您的蛋白樣本
可以使用各種方法在細胞裂解原液或其他樣本中富集或純化來自其他蛋白和組分的感興趣蛋白。離子交換和親和層析是部分或一步純化中常用的兩種策略。
親和純化
此純化方法也被稱為親和層析,通過將蛋白與固定化配體的特異性結合的性質實現。由于感興趣蛋白緊密結合,可以通過洗滌步驟去除污染物,可以從支持物中以高度純化的形式剝離(洗脫)結合的蛋白。親和純化是令人滿意的方法,因為它通常具有較高的蛋白產量并且所需步驟比其他純化方法少。它是純化重組或生物素化蛋白和抗體的優選方法。
離子交換 (IEX) 純化
該純化方法也被稱為離子交換層析,可以在特定 pH 下根據蛋白電荷進行分離。由于多個蛋白可能有類似的電荷,在多步純化過程的早期使用時,IEX 層析通常僅能部分純化感興趣蛋白。但是,IEX 樹脂也可以在最后精細純化步驟中用于去除其他純化步驟后持續存在的特定污染物。通常,蛋白在低離子強度下與 IEX 柱結合并通過在梯度下增加鹽濃度或更改 pH 值來差異地洗脫。陽離子交換樹脂與帶正電荷的蛋白相結合;陰離子交換樹脂與帶負電荷的蛋白相結合。離子交換樹脂被歸類為“弱”或"強",這是指官能團的電離狀態隨著 pH 值變化的程度。

蛋白純化的原理
1. 結合:使用特定配體捕獲感興趣蛋白。
2. 洗滌:在洗滌階段去除不需要的蛋白和其他雜質,如核酸。
3. 洗脫:此步驟反轉結合反應。您可以通過改變緩沖條件(如 pH 值、鹽濃度和去垢劑)或者加入競爭性結合物來洗脫和富集靶蛋白。
4. 精細純化:通過額外的層析步驟(通常為離子交換或體積排阻)充分利用靶蛋白的已知特性來去除剩余的微量雜質和其他污染物。
蛋白純化工作流程


使用 Pierce anti-DYKDDDDK 樹脂和其他產品的 DYKDDDDK 標簽 SUMO 蛋白產量和背景的比較。C 端和 N 端 DYKDDDDK 標簽的 SUMO 蛋白在大腸桿菌中表達并使用 Pierce Anti-DYKDDDDK 磁性瓊脂糖、Sigma-Aldrich® Anti-FLAG™ M2 磁珠和 MBL Anti-DDDDK 標簽 mAb 磁性瓊脂糖純化。用 Pierce 3x DYKDDDDK 肽競爭性洗脫標簽蛋白,通過使用 Invitrogen iBright 成像系統(B) 的 SDS-PAGE(A) 和密度測定法分析結果。起始裂解物和洗脫組分間的比較顯示了 DYKDDDDK 標簽蛋白的有效免疫沉淀和洗脫,與其他供應商產品相比,Pierce 磁性瓊脂糖的背景很少。
蛋白純化產品的特點:
· 產品選擇廣—可純化和富集蛋白和抗體的強離子交換和親和支持物;親和配體可實現重組和生物素化蛋白的1步純化,同時,活化的支持物可為定制蛋白固定化提供平臺
· 高性能—樹脂旨在較大程度地增加蛋白產量和減少背景
· 多種規格—磁珠、松散樹脂、FPLC 純化柱和96孔過濾板可實現從篩選和小規模階段到工藝規模純化的蛋白純化
· 經濟實惠—價格接近于其他主要供應商的價格或更優惠


離子交換、親和和活化支持物的概述

根據純化規模和應用選擇您的樹脂

小貼士
蛋白純化過程因要執行的下游分析而異。可以重復或省略某些步驟以獲得所需的結果。
步驟四:蛋白除雜-蛋白樣本除雜
蛋白提取配方中使用的許多去垢劑及鹽可能對蛋白功能或穩定性產生不良影響,或者可能干擾下游分析。因此,在細胞裂解或后續樣本處理(如蛋白純化)后,可能有必要去除或減少這些污染物。
小貼士
· 如果蛋白濃度太低而無法進一步處理或分析,可以使用離心濃縮管快速濃縮樣品。
· 若要在濃縮技術中進行緩沖液置換,可以使用置換緩沖液稀釋截留液并離心。此過程可以重復進行,直至達到所需置換或脫鹽水平。
蛋白樣本除雜產品

蛋白透析
透析是一種經典的除雜技術,它憑借選擇地擴散通過半透膜來去除小分子和不需要的化合物。將樣品和緩沖液置于膜的相對側。大于膜孔的蛋白保留在膜的樣品側,較小的分子(污染物)通過膜自由擴散,直至達到平衡濃度。這種技術可以使樣品中小分子污染物的濃度降低至可接受水平。
蛋白透析產品的特點:
· 出色的樣本回收率—與過濾和樹脂系統相比,低結合塑料和膜有助于盡可能減少樣本損失
· 便捷—易于抓握的設計有助于簡化使用進樣針和/或移液器添加和去除樣本
· 安全—密封膜有助于防止使用透析管和自制設備可能發生的泄漏
· 經驗證—每臺設備都在生產過程中經過泄漏檢測
產品推薦

*MWCO:截留分子量。
按截留分子量 (MWCO) 排列的蛋白回收率

使用 2K、3.5K、7K、10K 和 20K MWCO Thermo Scientific Slide-A-Lyzer 透析盒膜的樣本保留率。在 4°C 下,于鹽水或 0.2 M 碳酸鹽-碳酸氫鹽緩沖液 (pH 9.4) 中隔夜透析(17小時)各蛋白或維生素 B12 (1 mg/mL)。使用 Pierce BCA 蛋白測定試劑盒或者在 360 nm 處的吸收度(對于維生素 B12)評估保留物的量。

使用各種透析產品去除 NaCl 的速度。通過在指定時間測量保留物的電導率來確定樣本中 NaCl 的去除情況。(A)Slide-A-Lyzer 迷你透析裝置(10K MWCO,2 mL)與傳統透析的比較。室溫下,在軌道搖床 (300 rpm) 上用 50 mL 一次性錐形管中的 45 mL 水透析牛血清白蛋白 (BSA) 樣本(2 mL,0.25 mg/mL,溶于 1 M NaCl 中)。2小時后,換一次水。結果是兩個樣本的平均值。對于傳統透析,用燒杯中的 2 L 水通過攪拌透析樣本。在4小時內,去除了 95% 的 NaCl。(B) 室溫下,在 Pierce 96孔微量透析板中用 1.8 mL 水通過輕輕搖動透析 0.1 mL 樣本(含 1 M NaCl 的 0.4 mg/mL 細胞色素 C)。在4小時內,于第1、2、3小時更換緩沖液。2小時后,去除了 >83% 的 NaCl;4小時后,去除了 >99% 的 NaCl。(C) 室溫下,使用 2K、3.5K、10K 和 20K MWCO Slide-A-Lyzer 透析瓶透析含 1 M NaCl 的 200 mL 樣本中的蛋白。2小時和5小時后,更換透析緩沖液 (4 L)(三角形;此外,在 2K 狀態下是41小時)。在8至18小時內,去除了超過 95% 的 NaCl(2K 條件下為41小時)。
蛋白樣本脫鹽
體積排阻色譜法也稱凝膠過濾法,可用于去除樣本中的鹽分。使用這種技術時,需要選擇一種孔尺寸足以使小分子鹽進入但感興趣蛋白不能進入的樹脂。這會使得污染物減緩其遷移率。在重力流或離心過程中,將較大、較快的蛋白與較慢、較小的分子分離。
蛋白脫鹽產品的特點:
· 高性能—專有樹脂可實現出色的蛋白回收和高效的污染物去除
· 靈活—可采用離心柱、過濾離心板和純化柱規格以滿足各種需求
· 快速—無需組分篩選或等待蛋白通過重力流出現
· 經濟—產品價格實惠、性能出色
產品推薦

蛋白回收率和樣本稀釋度的比較

與其他產品相比,Zeba 離心脫鹽柱可在較大樣本濃度和體積範圍下達到對樣本的較低稀釋的同時,亦實現了高蛋白回收率。Zeba 離心脫鹽柱(10 mL,7K MWCO)和 GE PD-10 柱用于對 0.04、0.2 和 1 mg/mL 濃度的 1.5、2.5 和 3.5 mL BSA 樣本進行脫鹽。根據制造商推薦的方案進行脫鹽;針對 GE PD-10 使用離心和重力方案。利用 SDS-PAGE 分析蛋白回收率。對于各電泳凝膠,在泳道1中加入等于 1 μg BSA 的起始樣本的等份試液作為上樣對照品;在凝膠中加入體積相同的其他所有脫鹽樣本作為上樣對照品。不同泳道之間的強度差異是脫鹽引起的蛋白回收率和樣本稀釋度組合。回收和濃縮的最大差異均在突出顯示的區域中注明。
蛋白濃縮管
蛋白濃縮與透析法類似,其使用半透膜將蛋白與小分子量化合物分離。與透析法的被動擴散原理不同,濃縮是使用離心使溶液穿過膜而實現的。在離心過程中,緩沖液和小分子量溶質均被動穿過膜,并在另一側收集(濾液)。大分子(蛋白)保留在膜的樣品側,其隨著試劑被動穿過膜到達另一側而濃縮為小體積液體(截留液)。
蛋白濃縮管產品的特點
· 快速處理—設計可較大限度地減少膜積垢,且使用 10K MWCO 濃縮管時,在 5-30 分鐘內可將樣本濃縮 10-30 倍(使用其他 MWCO 濃縮管時,濃縮時間可能不同),即使是帶粒溶液亦是如此。
· 高回收率—在去除污染物或置換緩沖液的同時,保留 >90% 的蛋白樣本
· 方便—醒目標記、寬樣本槽和可拆卸過濾槽便于輕松操作
· 兼容儀器—可與使用固定角或旋轉吊籃轉頭的標準離心機配合使用
產品推薦
*針對各 MWCO 使用四種不同的蛋白溶液

Pierce 蛋白濃縮管(使用 3K、5K、10K、30K 或 100K MWCO)以及其他供應商的 0.5 mL、6 mL、20 mL 和 100 mL 濃縮管的蛋白回收率比較。根據制造商的說明,在 Pierce 蛋白濃縮管和其他供應商的濃縮管中離心不同蛋白溶液的樣本:0.5 mL (15,000 x g)、5 mL (4,000 x g)、20 mL (4,700 x g) 和 100 mL (1,200 x g)。離心樣本,直至樣本體積減少至 15-30 分之一以下;通過 Pierce BCA 蛋白測定試劑盒(僅 0.5 mL 濃縮管)或在 A280 吸收度下測定蛋白濃度。
步驟五:蛋白定量和檢測-定量并檢測您的靶蛋白
根據實驗需要,可以使用多種方法來檢測和分析靶蛋白。以下是用于檢測和分析復雜混合物(例如裂解物和血清)中蛋白質的常見技術,以及各種方法的特點和常見要求。
總蛋白定量
總蛋白濃度測定是通過生化方法分離和分析蛋白的工作流程中的重要步驟。測定方法可以使用通過熒光計、分光光度計或酶標儀進行的比色法或熒光法檢測。 根據分析類型和所分析特定蛋白樣品的不同,每種蛋白檢測方法都存在其局限性。選擇蛋白檢測方法時需要考慮的重要特性包括靈敏度(檢測下限)、與樣品中常見物質(例如去垢劑、還原劑、離散劑、抑制劑、鹽和緩沖液)的兼容性、標準曲線線性度以及蛋白間差異。
比色法蛋白定量
可使用酶標儀或分光光度計檢測比色信號。我們的比色法蛋白定量試劑有:
· BCA 測定—蛋白-銅螯合及還原銅的二次檢測。
· Bradford 測定——蛋白-染料結合,可直接檢測與結合染料相關的顏色變化。
熒光法蛋白定量
基于熒光進行蛋白定量是除比色法以外的另一選擇。熒光檢測法具有出色的靈敏度,所需蛋白樣本較少,因而可留下較多樣本以供其他實驗使用。此外,讀取時間并非關鍵因素,因此這種檢測方法可輕松應用于自動化高通量分析。可使用熒光計或酶標儀檢測熒光信號。

小貼士
· 任何試劑都無法做到理想蛋白測定。每種方法都有其優勢和劣勢。
可根據樣品類型、檢測時間、讀數(比色法或熒光法)以及與去垢劑或還原劑的兼容性,通過交互式蛋白測定選擇指南來選擇產品。
· 如要了解有關不同蛋白濃度定量方法的信息,請繼續閱讀這篇文章:蛋白測定概述。
蛋白檢測

*使用高靈敏度 HRP 底物,例如 SuperSignal West Atto 非常敏感底物
蛋白定量和檢測產品


#蛋白純化# #蛋白純化儀# #蛋白純化方法# #蛋白純化實驗步驟#
賽默飛世爾科技(中國)有限公司
免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號




















 采購中心
采購中心