細胞類器官培養簡史:Kirkstall Quasi Vivo Organs-on-a-Chip
北 京 基 爾 比 生物科技公司主營產品:
Kilby 全自動3D細胞類器官培養儀,
Kilby Gravity 微重力三維細胞培養系統,
Kilby Bio類器官芯片搖擺灌注儀,動態3D細胞培養系統
Kirkstall Quasi Vivo®類器官3D仿生動態共培養系統
一、關鍵詞
細胞培養、二維細胞培養、三維細胞培養、類器官、球體、器官芯片
二、摘要
概述了細胞培養領域的歷史里程碑,從19世紀80年代Wilhelm Roux的開創性實驗,到Ross Granville Harrison在20世紀初的奠基工作,再到Alexis Carrel的永生化細胞研究。
后續Johannes Holtfreter、Aron Moscona、Joseph Leighton等推動了三維細胞培養發展,2006年Takahashi和Yamanaka誘導多能干細胞(iPSCs)的發現具有革命性意義。近年來,球體、類器官和器官芯片技術成為研究熱點,文章還探討了從二維到三維細胞培養的轉變及未來方向。

三、細胞培養歷史概述
1. 早期起源(19世紀末-20世紀初)
- Robert Koch(19世紀80年代):改進微生物培養技術,使用明膠固化培養基,提出“科赫法則”,強調滅菌的重要性,與Richard Petri合作改進培養皿(Petri dish)。
- Wilhelm Roux(19世紀80年代):通過雞胚細胞實驗,證明細胞可在鹽溶液中在體外存活。
- Leo Loeb:在華盛頓大學開展細胞培養、移植和激素研究,為實驗病理學奠定基礎。
- Ross Granville Harrison(1906年):在試管中培養蛙神經纖維組織,使用、鹽溶液和瓊脂作為培養基,開發“懸滴技術”,通過無菌操作(如滅菌手術器械)將細胞培養延長至5周,其著作《Observations on the Development of Living Nerve Fibers》具有重要意義。
2. 技術發展與突破(20世紀初-中期)
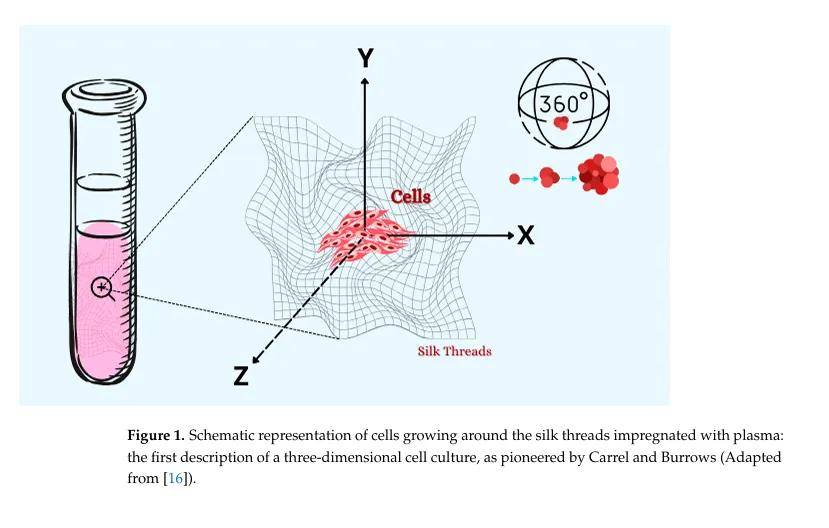
- Alexis Carrel:1912年諾貝爾生理學或醫學獎得主,改進懸滴培養法,設計“卡雷爾培養瓶”,詳細描述三維細胞培養(利用絲綢線培養組織碎片),與Charles Lindbergh合作,后者開發血清分離方法并引入耐高壓的“Pyrex玻璃”器皿,成功培養出永生化雞胚心肌細胞系。
- HeLa細胞系(1951年):源于Henrietta Lacks的宮頸腺癌組織,由George Gay實驗室培養成功,具有強增殖能力,至今仍廣泛應用于研究。
- 三維培養技術先驅:
- Johannes Holtfreter:開發球形細胞聚集體培養方法,通過攪拌培養瓶促進細胞接觸和營養擴散。
- Aron Arthur Moscona:利用錐形瓶持續攪拌培養細胞,防止細胞貼壁,促進三維細胞聚集體形成,開展細胞嵌合體研究。
- Joseph Leighton(20世紀50年代):使用纖維素海綿三維基質培養細胞,證明三維培養更能模擬體內細胞行為。
3. 干細胞研究與突破(20世紀60年代-21世紀初)
- 骨髓干細胞研究:Ernst McCulloch和James Till(20世紀60年代初)通過骨髓細胞移植實驗,提出“脾集落”概念,為骨髓干細胞定義奠定基礎。
- 間充質干細胞研究:Alexander Friedenstein(20世紀60年代起)從骨髓中分離出“成纖維細胞集落形成細胞(FCFCs)”,即間充質干細胞的前身,證明其多向分化潛能。
- 胚胎干細胞:1981年,Martin Evans和Matthew Kaufman建立小鼠囊胚細胞系,Gail R. Martin使用“胚胎干細胞”術語。
- 人類胚胎干細胞:1998年,James Thomson團隊從人類囊胚內細胞團培養出人類胚胎干細胞。
- 誘導多能干細胞(iPSCs):2006年,Kazutoshi Takahashi和Shinya Yamanaka通過Oct3/4、Sox2、Klf4、c-Myc四因子將成纖維細胞重編程為iPSCs;2007年,James Thomson團隊使用Oct4、Sox2、NANOG、Lin28四因子獲得人類iPSCs。
四、二維與三維細胞培養技術
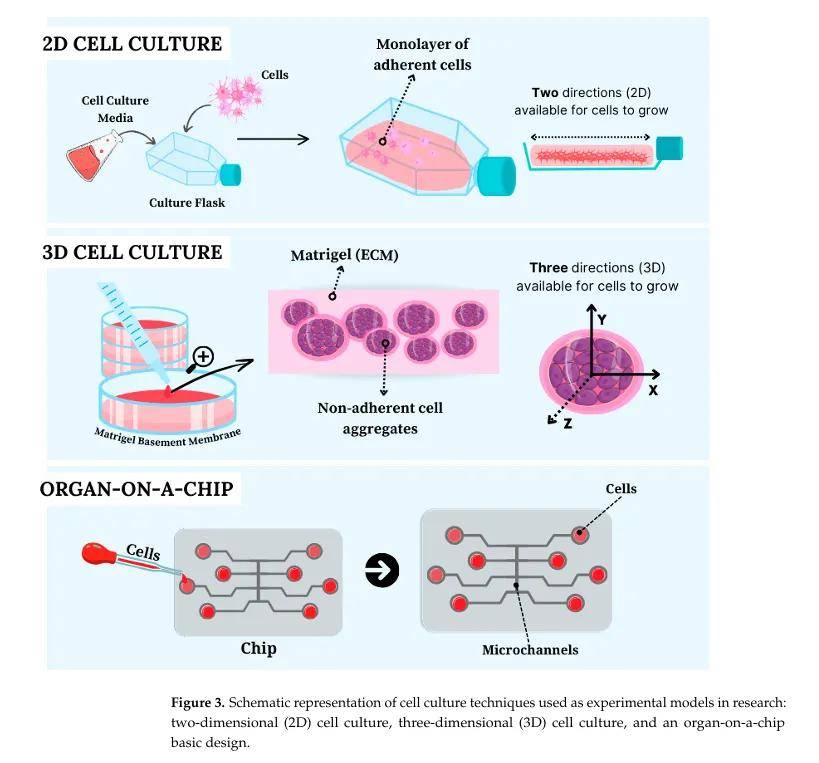
1. 二維(2D)細胞培養
- 原理:細胞在平面貼壁表面(如培養皿、培養瓶)生長,通過特定涂層(如多聚賴氨酸、Matrigel、纖連蛋白)促進非貼壁細胞黏附。
-應用:用于研究細胞分化、遷移、生長等生理機制,廣泛應用于癌癥研究、毒性測試(如藥物候選物評估),符合“3Rs”原則(減少、優化、替代動物實驗)。
- 局限性:缺乏細胞與細胞外基質的接觸,難以模擬體內細胞結構和生理特性,部分細胞系(如肝細胞)難以在二維環境中穩定培養。
2. 三維(3D)細胞培養
- 球體(Spheroids):由細胞自組織形成的球形聚集體,無需預定義基質,可通過懸滴法、磁懸浮等方法制備,存在營養、氧氣等梯度,核心易形成壞死區,適用于癌癥模型研究。
- 類器官(Organoids):比球體更復雜,由干細胞或分化細胞形成,具有自組織、多細胞性和功能性,可模擬器官發生和功能,應用于遺傳疾病、腫瘤、藥物研發等領域(如腦類器官研究小頭畸形,肝類器官研究囊性纖維化)。
- 發展里程碑:1970年Robert Sutherland開發多細胞球體;1972年Tom Elsdale和Jonathan Bard使用膠原蛋白凝膠作為三維支架;1977年Matrigel被引入作為細胞外基質提取物。
- 局限性:缺乏功能性血管化,導致營養分布不均和壞死;結構組織與體內器官存在差異;操作復雜、成本高。
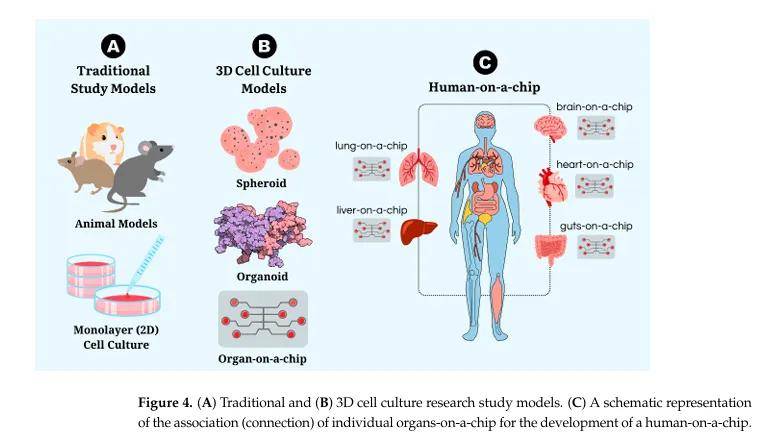
五、器官芯片(Organ-on-a-Chip)
- 原理:基于微流控系統,將三維細胞培養集成在芯片中,通過微通道實現細胞間相互作用,可模擬血管化、機械刺激和組織灌注。 例如英國Kirkstall Quasi Vivo多功能細胞類器官芯片
- 典型模型:
- 肺芯片(2010年):由多孔膜分隔的兩個微通道組成,分別培養肺泡上皮細胞和肺微血管內皮細胞,可模擬呼吸運動和肺部感染。
- 心臟芯片:基于人類iPSCs分化的心肌細胞,可模擬心臟收縮(頻率55~80 bpm),用于藥物評估。
- 腦芯片:模擬神經祖細胞遷移,用于神經發育和腫瘤研究。
- 肝芯片、腎芯片、胰腺芯片:分別用于評估肝毒性、腎毒性和研究囊性纖維化相關胰腺功能障礙。
六、細胞培養的新展望
- 人體芯片(Human-on-a-Chip):整合多個器官芯片,通過微通道模擬全身生理相互作用,有望替代動物實驗,用于系統生物學研究和藥物測試。
- 挑戰:缺乏通用細胞培養基;血管化技術尚未成熟;微通道設計需模擬體內血管特性。
- 應用前景:推動個性化 medicine 發展,加速藥物研發,深入解析疾病機制。

七、結論
二維細胞培養為生物醫學研究奠定了基礎,但存在局限性;三維細胞培養(球體、類器官)和器官芯片技術通過模擬體內微環境,在臨床前研究、藥物篩選和再生醫學中顯示出巨大潛力,未來將進一步縮小基礎研究與臨床應用的差距。
北 京 基 爾 比 生物科技公司主營產品:
Kilby 全自動3D細胞類器官培養儀,
Kilby Gravity 微重力三維細胞培養系統,
Kilby Bio類器官芯片搖擺灌注儀,動態3D細胞培養系統
Kirkstall Quasi Vivo®類器官3D仿生動態共培養系統

請聯系我們,了解更多產品詳情!
免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號


















 采購中心
采購中心