鐵死亡與多種疾病如神經退行性疾病、心血管疾病及癌癥均有著密切聯系。鐵死亡誘導劑常用于消除癌細胞、炎性細胞等病變細胞,也可與化療或放射療法聯用。鐵死亡抑制劑在神經退行性疾病、心血管疾病等疾病中顯示出保護作用,抑制鐵死亡可以減輕病理過程帶來的細胞損傷和功能喪失。因此,研究鐵死亡可為疾病機制的理解、治療靶點的發現、抗腫瘤藥物的開發、克服傳統化療的耐藥性提供新方向[1][2][3]。
0
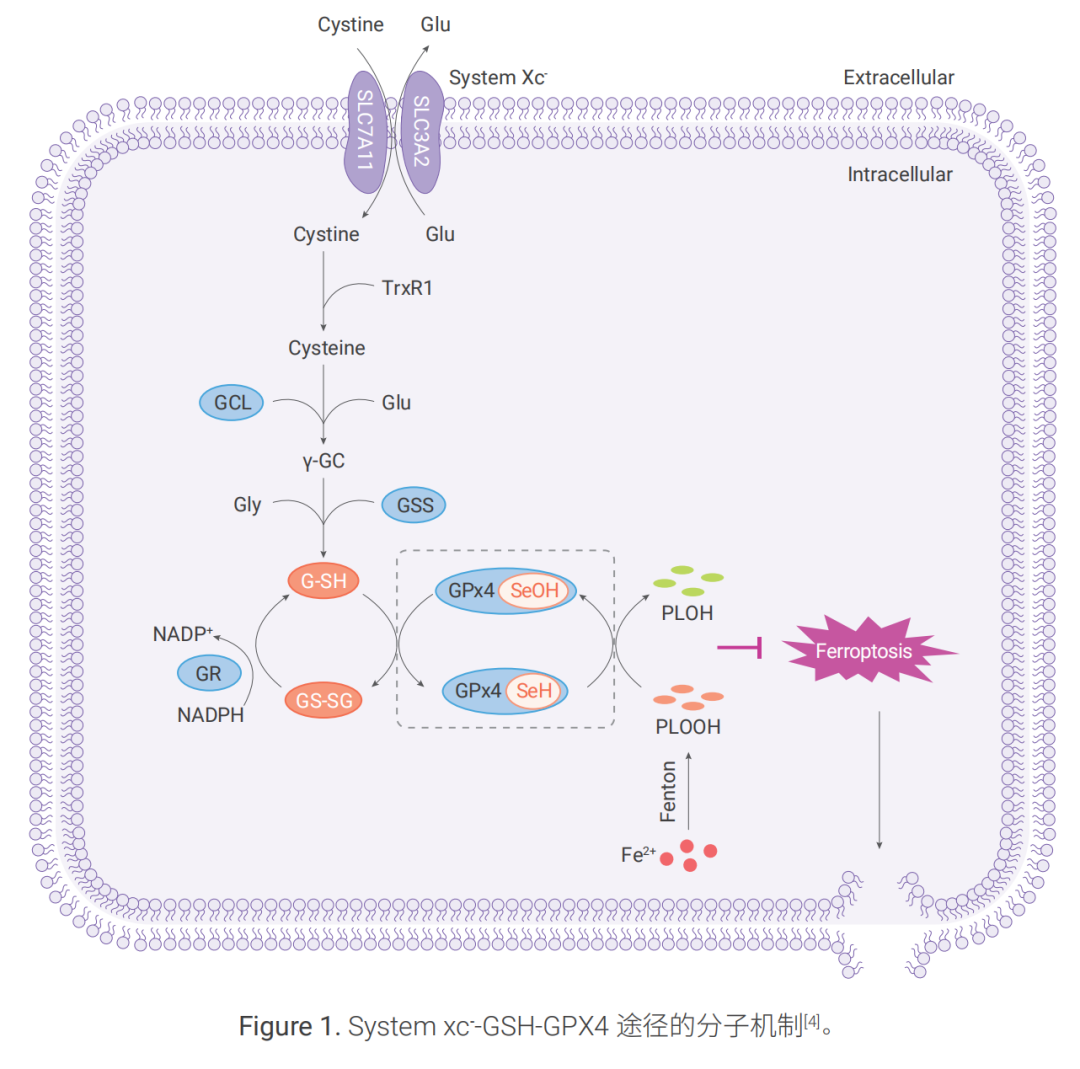
System xc- -GSH-GPX4 是細胞內重要的抗氧化體系,主要通過三個步驟發揮作用。
1.1 System xc- —關鍵上游節點
System xc- 由 2 個亞基(SLC7A11 和 SLC3A2)組成。 SLC7A11 為功能亞基,負責主要的轉運活性, 對胱氨酸(Cystine; Cys2)和谷氨酸(Glu)有高度特異性,而 SLC3A2 則作為伴侶蛋白。 System xc- 以 1:1 的比例進行胞內谷氨酸和胞外胱氨酸的交換轉運。
1.2 GSH—核心的抗氧化劑
胱氨酸進入細胞后,可被GSH 或硫氧還蛋白還原酶 (TrxR1)還原為半胱氨酸(Cysteine; Cys)。隨后, 半胱氨酸在谷氨酸 - 半胱氨酸連接酶(GCL)和谷胱甘肽合成酶(GSS)的催化作用下合成 γ- 谷氨酰 半胱氨酸 (γ-GC)。隨后,γ-GC和甘氨酸(Gly)被GSS催化生成谷胱甘肽(GSH)。GSH 的其他來源可能 包括反式硫化途徑(transsulfuration),該途徑受氨酰基 -tRNA合成酶家族(如CARS1)的負向調節。
GSH以還原型 (G-SH) 和氧化型(GS-SG,谷胱甘肽二硫化物 ) 存在,GSH 通過G-SH和GS-SG 之間的 轉換發揮電子供體或受體的作用,從而維持細胞中氧化還原穩態。
1.3 GPX4—核心下游抗氧化劑
Fe2+ 可通過芬頓反應產生大量的磷脂氫過氧化物(PLOOH)。谷胱甘肽過氧化物酶(GPX4)能夠利用 GSH 將 PLOOH 還原為脂質醇(PLOH),從而保護細胞免于鐵死亡。具體而言,在 GPX4 的催化循環中, 硒醇(-SeH)是 GPX4 的主要活性基團,GSH 是 GPX4 的主要還原性輔因子,-SeH 被 PLOOH 氧化成硒酸 (-SeOH),GSH 可以還原 -SeOH 并進一步激活 GPX4,釋放 GS-SG 以防止 GPX4 失活。GS-SG 在谷胱甘肽還原酶(GR)和輔酶 NADPH 的作用下被還原為 G-SH。
| Cat. No. | Product Name | Bioactivity |
| Lovastatin 洛伐他汀 | ||
| Simvastatin 辛伐他汀 |
| Cat. No. | Product Name | Bioactivity |
| Dopamine多巴胺 | 增強GPX4蛋白的穩定性 | |
| HY-14909 | Bardoxolone(CDDO)巴多索隆 | 抑制 和脂質過氧化HSP90,進而抑制GPX4 降解 |
| HY-Y0326 | β-Mercaptoethanol β-巰基乙醇 | |
| HY-115627 | PKUMDL-LC-101-D04 | GPX4 激活劑 |
| HY-N0382 | Galangin 高良姜素 | 激活SLC7A11/GPX4 |
| HY-14590 | Kaempferol 山-奈酚 |
MCE 客戶使用產品發表的部分文獻
Nature.2024 Jul;631(8021):654-662.
Nature. 2024 Feb;626(7998):411-418.
Nature. 2020 Mar;579(7799):433-437.
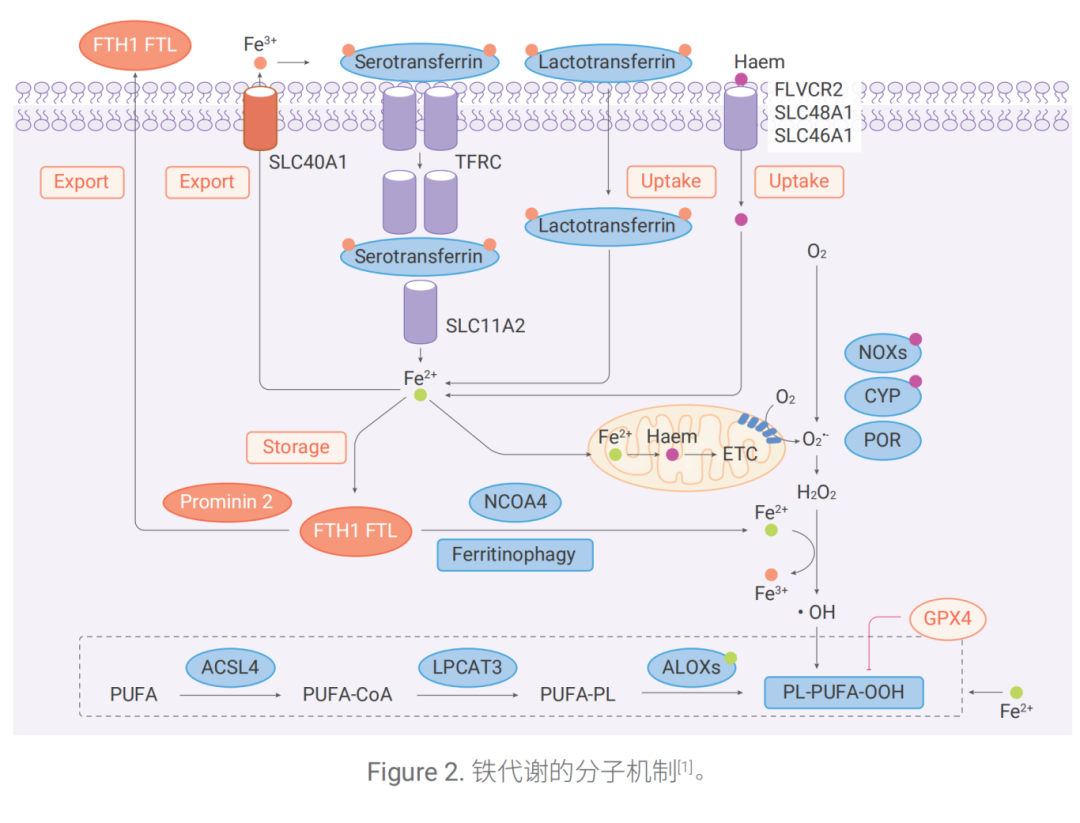
2.1 鐵的攝取
血清轉鐵蛋白(Serotransferrin)通過轉鐵蛋白受體(TFRC)介導 Fe3+ 的攝取,進入細胞后在內體酸性 環境中被還原為 Fe2+,由金屬轉運體 SLC11A2(也稱 DMT1)釋放至細胞質中。
此外,乳鐵蛋白 (Lactotransferrin)和血紅素(Haem)通過細胞膜中的不同吸收途徑提供額外的鐵來源。另外, 鐵儲存蛋白復合物(FTH1/FTL)可通過 NCOA4介導的自噬被降解(Ferritinophagy),從而增加 Fe2+ 的水平。
過量的 Fe2+ 可以通過兩種機制產生活性氧(ROS),隨后導致脂質過氧化,誘導鐵死亡。
1. 鐵依賴性芬頓反應;
2. 激活含鐵酶如脂氧合酶(ALOXs)。ACSL4和LPCAT3促進多不飽和脂肪酸(PUFA)摻入磷脂中形成 含多不飽和脂肪酸的磷脂(PUFA-PL),并對 ALOXs介導自由基引發的氧化作用敏感,從而產生 PL-PUFA-OOHs。
2.2 鐵的流出
Fe2+ 主要由細胞膜上的 SLC40A1 輸出,但也可以通過 Prominin 2 介導的外泌體(Exosome)以鐵蛋白 的形式輸出,從而抑制鐵死亡。
MCE 客戶使用產品發表的部分文獻
Cell Metab. 2024 Sep 28:S1550-4131(24)00366-8.
Nat Cell Biol. 2024 Sep;26(9):1545-1557.
Cell Mol Immunol. 2023 Jan;20(1):51-64.
Nat Cell Biol. 2021 Jan;23(1):40-48.
Nat Nanotechnol. 2021 Oct;16(10):1150-1160.
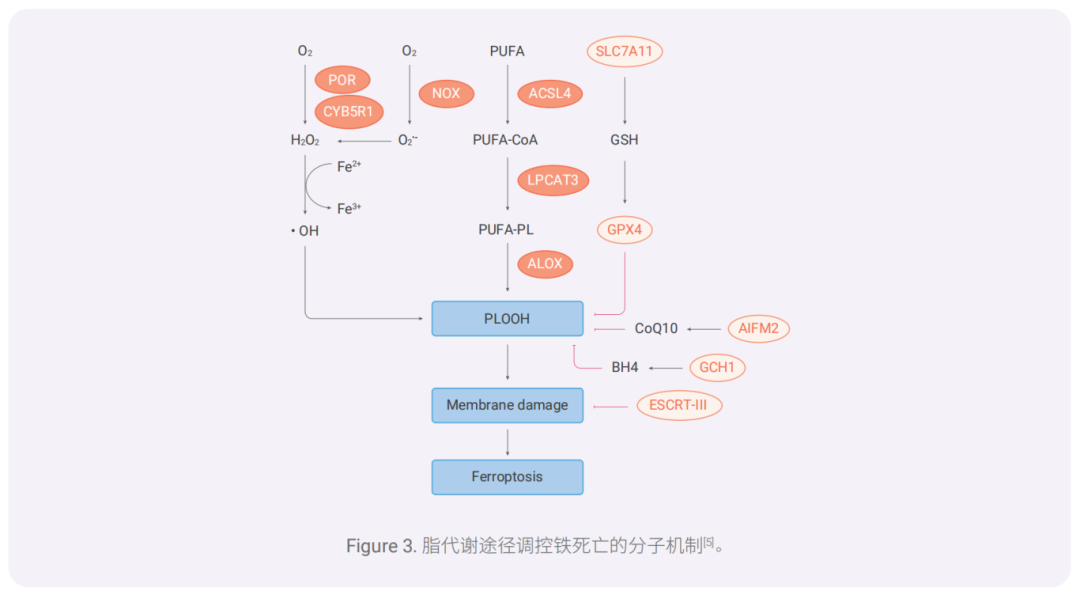
除了通過激活 ACSL4-LPCAT3-ALOX 軸以外,幾種膜電子轉移蛋白如細胞色素 P450 氧化還原酶(POR) 和 NADPH 氧化酶(NOX)可促進鐵死亡中脂質過氧化產生。POR 與細胞色素 B5 還原酶 1(CYB5R1) 的偶聯 會介導 H2O2 的產生,NOX 介導 O2 •- 的產生,隨后通過鐵催化的芬頓反應驅動脂質過氧化和鐵死亡。因此, POR/CYB5R1,NOX 和 ACSL4-LPCAT3-ALOX 途徑均可促進 PLOOH 的產生。
相反,System xc- -GSH-GPX4,AIFM2-CoQ10,GCH1-BH4 軸的激活限制了鐵死亡中的脂質過氧化。 PLOOH 介導的膜損傷可以通過 ESCRT-III 膜修復系統進行修復。
| ACSL4 抑制劑 PPARγ 激動劑 | ||
MCE 客戶使用產品發表的部分文獻
Cell. 2024 Nov 19:S0092-8674(24)01270-4.
Cancer Cell. 2024 May 13;42(5):869-884.e9.
Cell Metab. 2023 Jan 3;35(1):200-211.e9.
Cell Metab. 2021 Mar 2;33(3):581-597.e9.
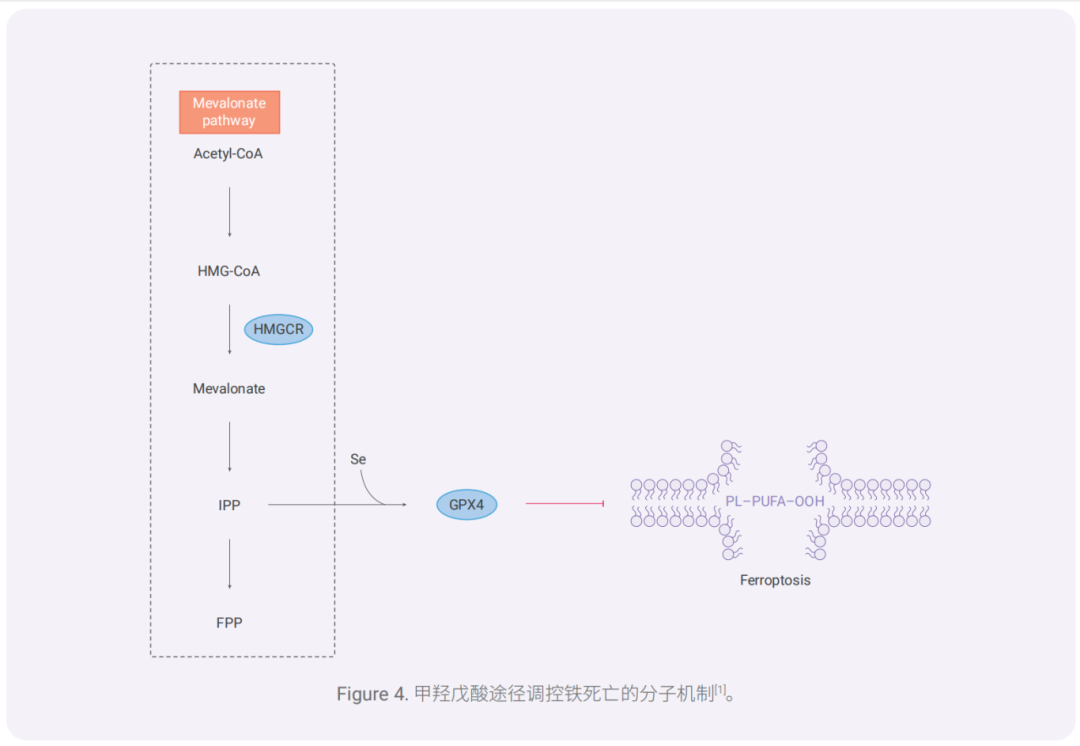
0
MVA 通過一系列酶促步驟轉化為異戊烯基二磷酸(IPP)。IPP 可調控 硒代半胱氨酸(Sec)-tRNA 的成熟。Sec 是 GPX4 活性中心的氨基酸之一,其合成需要 Sec-tRNA 作為轉運體。 因此,MVA 途徑可通過調節 Sec-tRNA 的成熟來影響 GPX4 的合成,從而調控鐵死亡。
知識卡片
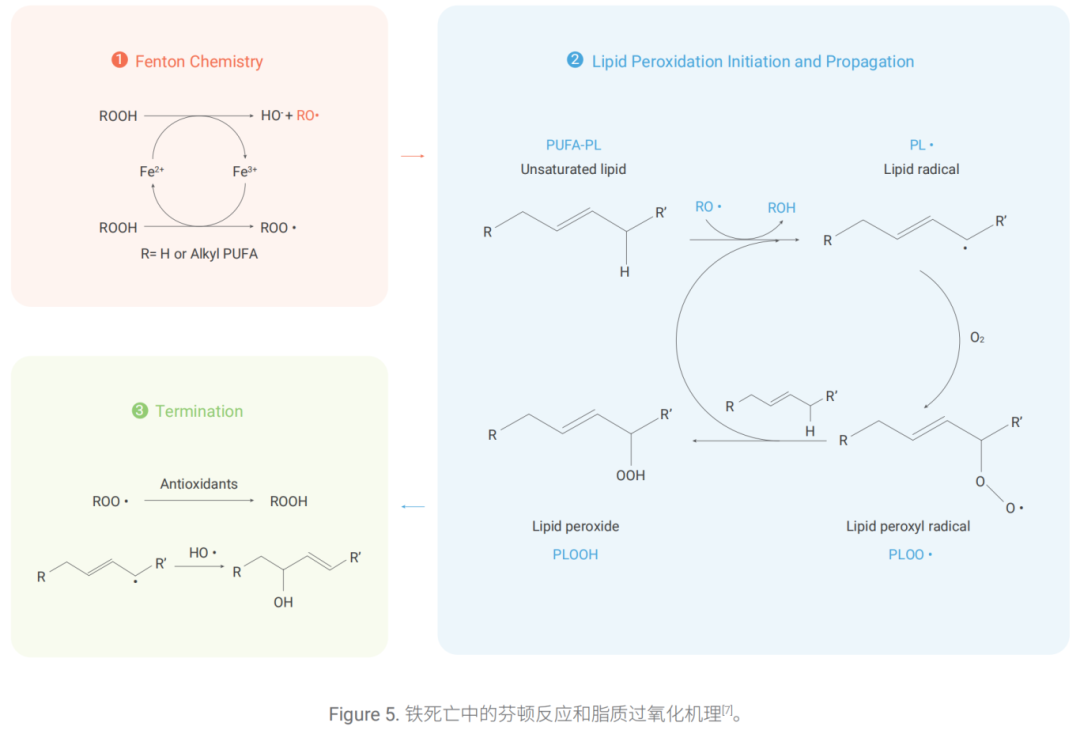
在鐵死亡的芬頓反應中,第一步是 H2O2 在 Fe2+ 存在下生成強氧化能力的羥基自由基(•OH), •OH 能夠從含 多不飽和脂肪酸的磷脂(PUFA-PL)的雙烯丙基位置奪取氫原子,生成脂質自由基(Lipid radical, PL•),并與 氧分子發生反應,從而形成脂質過氧化自由基(Lipid peroxyl radical, PLOO•)。
PLOO• 可從磷脂(PL)分子中 提取氫形成脂質過氧化物 (PLOOH)和脂質自由基(PL•),形成連鎖反應。在 Fe2+ 的存在下,PLOOH 可被還原 成 PL-O•,有助于連鎖反應傳播。
研究發現,許多抗氧化劑(例如:Ferrostatin-1, Liproxstatin-1),可捕獲自由基,抑制鐵死亡過程中由芬頓反應 驅動的 PUFA-PL 的自氧化 [7][8]。
MCE 熱銷產品— 抗氧化劑
MCE 客戶使用產品發表的部分文獻
Nature. 2024 Jul;631(8021):654-662.
Cell Stem Cell. 2024 Oct 3;31(10):1484-1500.e9
Cell. 2024 Feb 1;187(3):624-641.e23.
Nat Nanotechnol. 2021 Oct;16(10):1150-1160.
5.1 AIFM2-CoQ10 通路
CoQ10 的還原形式泛醇(Ubiquinol)可捕獲脂質過氧化物自由基,抑制脂質過氧化,而 AIFM2(FSP1) 可催化 CoQ10 的再生,也可通過激活 ESCRT-III 膜修復系統來預防癌細胞中的鐵死亡[1][9]。
5.2 ESCRT-III 膜修復系統
ESCRT-III 系統(由 12 個亞基組成)是一種重要的膜修復機制,可以限制壞死性凋亡、細胞焦亡和 鐵死亡[10]。
5.3 GCH1-BH4 通路
GCH1 是 BH4(抗氧化劑)合成的限速酶,而 BH4 的含量會影響細胞對鐵死亡的敏感性。GCH1-BH4 軸 可控制 BH4 的內源性產生、CoQ10 豐度,以及異常磷脂的過氧化,從而抑制鐵死亡[11]。
5.4 DHODH 通路
DHODH,位于線粒體內膜外表面的酶,是細胞增殖和 DNA合成中的重要酶。DHODH 負責催化嘧啶 核苷酸合成途徑中二氫乳清酸(DHO)氧化為乳清酸(OA),同時將內膜中的CoQ10 還原為泛醇 (Ubiquinol)來抑制線粒體內膜的鐵死亡。DHODH 所介導的抗鐵死亡機制獨立于細胞質中的 GPX4 和 FSP1 路徑。因此,在線粒體 GPX4 功能缺失時,DHODH 能通過維持 CoQ10/泛醇抗氧化系統來部分 補償,從而延緩鐵死亡的發生 [12]。
MCE 熱銷產品
MCE 客戶使用產品發表的部分文獻
Nature. 2024 Feb;626(7998):411-418.
Nature. 2022 Apr;604(7904):134-140.
Cell Discov. 2022 May 3;8(1):40.
客戶驗證
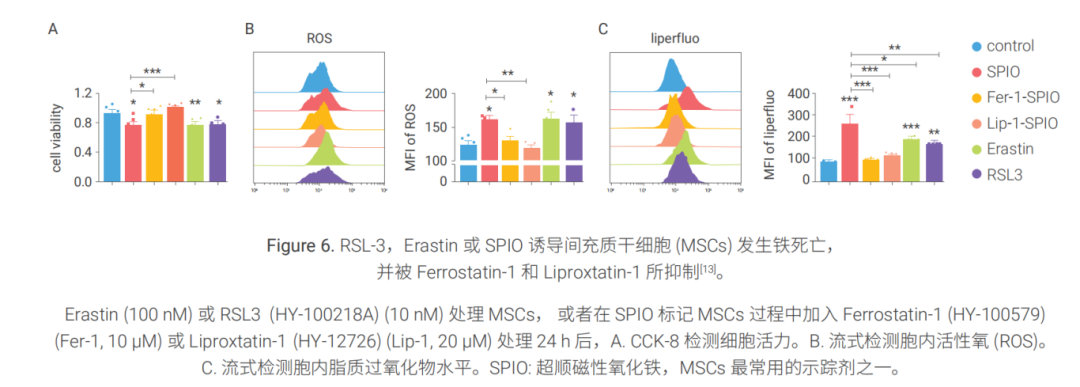
案例一:鐵死亡誘導劑與抑制劑調控 MSCs 細胞鐵死亡
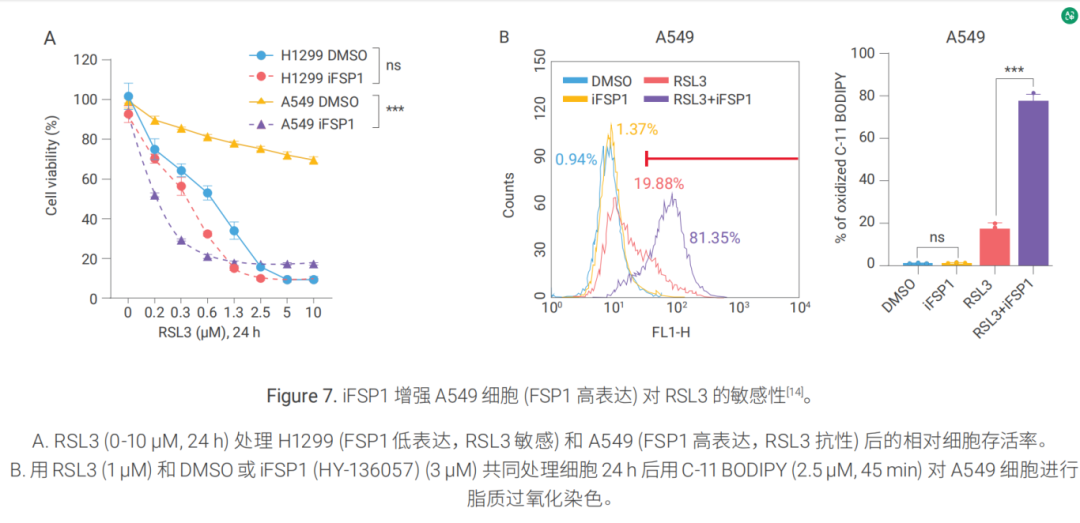
案例二:FSP1 抑制劑增強 A549 細胞對鐵死亡誘導劑的敏感性
MCE 驗證數據
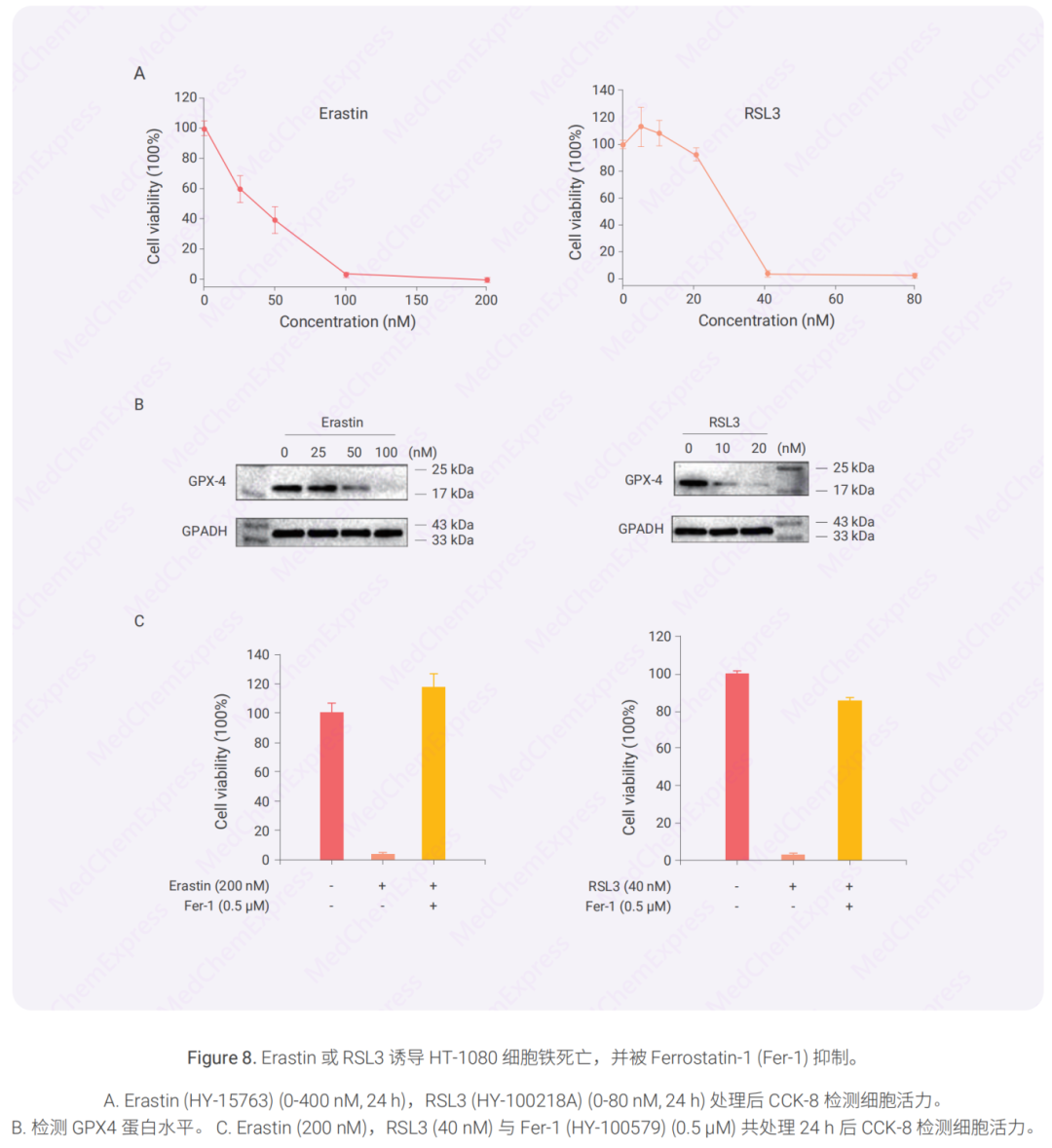
案例:鐵死亡誘導劑與抑制劑調控 HT-1080 細胞鐵死亡
[2] Cell. 2022 Jul 7;185(14):2401-2421.
[3] Cell Death Dis. 2020.11:88.
[4] Front Pharmacol. 2022 Aug 29;13:910292.
[5] Front Cell Dev Biol. 2021 Mar 25;9:646890.
[6] Signal Transduct Target Ther. 2021 Feb 3;6(1):49.
[7] PLoS Biol. 2018 May 24;16(5):e2006203.
[8] Front Pharmacol. 2024 May 23;15:1407335.
[9] Nature. 2019 Nov;575(7784):693-698.
[10] Biochem Biophys Res Commun. 2020 Feb 5;522(2):415-421.
[11] ACS Cent Sci. 2020 Jan 22;6(1):41-53.
[12] Nature. 2021 May;593(7860):586-590.
For research use only. We do not sell to patients.
免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號

















 采購中心
采購中心