聯系電話
- 聯系人:
- 蘇小姐
- 電話:
- 400-820-3556
- 手機:
- 18521301252
- 地址:
- 上海市浦東新區環科路999弄浦東國際人才港13號樓2樓
掃一掃訪問手機商鋪
隨著生物醫藥技術的迅猛進步,哺乳動物細胞系因其連續傳代的特性,在疫苗和治療性生物制品的生產中發揮著日益重要的作用。然而,這種生產過程中不可避免地會涉及宿主細胞和病毒殘余DNA的傳遞問題,進而可能給受種者帶來癌基因激活和病毒感染的風險。因此,核酸殘留問題成為了藥品監管部門關注的焦點,特別是關于其安全性評價。
殘留DNA(rDNA)的潛在危害不容忽視。其中,感染性rDNA指的是那些能夠整合到染色體外或存在于其中的DNA病毒,以及反轉錄病毒中的潛在前病毒基因組。這些感染性成分可能直接對受種者的健康構成威脅。此外,rDNA還可能具有致瘤性,這主要是通過兩種機制實現的:一是引入顯性致癌基因,如myc和ras等,導致正常細胞分化異常,進而可能產生致瘤性;二是rDNA的插入可能引起正常細胞的基因突變。盡管由于DNA整合頻率相對較低,這種致癌現象并不常見,但一旦發生,后果可能是嚴重的。
除了感染性和致瘤性,rDNA還可能引發免疫原性反應。這種免疫原性往往來自于細菌DNA中富含的CpG序列。當這些序列進入人體后,可能觸發免疫系統的反應,導致不必要的健康風險。
鑒于rDNA的這些潛在危害,生物制品生產過程中對殘留核酸的檢測和去除顯得尤為重要。世界衛生組織(WHO)及各國藥物監管機構均對此有明確規定,要求用于治療用途的重組生物制品中的核酸污染應嚴格控制在一定范圍內。一般來說,每劑最終產品中的核酸污染應限制在100 pg以下,特殊情況下也不得超過10 ng。
為了實現這一目標,生物制品生產企業需要采取一系列措施,包括優化生產工藝、加強原材料的質量控制、采用高效的核酸去除技術等。同時,監管部門也應加強監管力度,確保企業嚴格按照規定進行生產,以保障公眾用藥安全。
綜上所述,生物醫藥技術的發展為疫苗和治療性生物制品的生產提供了更多可能性,但同時也帶來了新的挑戰。對于rDNA等核酸殘留問題,我們需要從多個方面入手,加強研究和監管,確保生物制品的安全性和有效性。
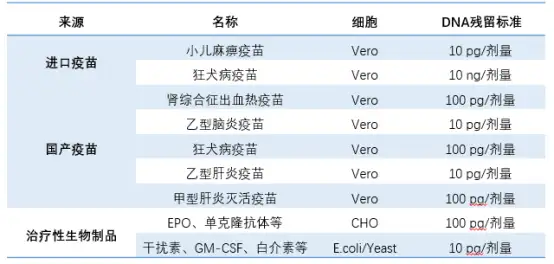
表1:我國部分疫苗及治療用生物制品殘余DNA標準
鑒于rDNA去除過程中遇到的聚集、包裹以及沉淀等挑戰,傳統的去除方法效率確實不盡如人意,而酶解法盡管有效,但操作復雜且條件難以穩定。因此,尋找一種高效且易于操作的核酸去除方法顯得尤為重要。
逐典Pannarase全能核酸酶作為一種非特異性核酸內切酶,展現出了優勢。其來源于Serratia marcescens,能夠在多種條件下高效降解各種形式的DNA和RNA,生成特定大小的寡核苷酸殘基片段。這種酶對核酸堿基序列沒有特異性要求,意味著它可以在核酸鏈內的任意位置進行切割,從而大大提高了去除殘留核酸的效率。
逐典Pannarase全能核酸酶優勢:
1.無動物源性、無氨芐青霉素
2.杰出單位比酶活、更高效的核酸降解能力
3.先進的生產工藝,非傳統His標簽純化、排除引入金屬離子風險
4.嚴格的質控標準,內毒水平低,確保單位酶活的準確性以及批次間穩定性
全能核酸酶應用條件:
全能核酸酶的酶活會受到多種因素的影響(例如溫度、pH、離子強度等),故用量范圍也會從0.1 U/mL-250 U/mL不等。因此,不同的操作環境下酶的最佳濃度不同,需要通過實驗設置梯度進行最佳條件的摸索。
應用實例:
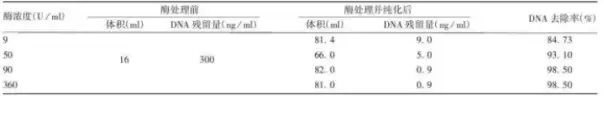
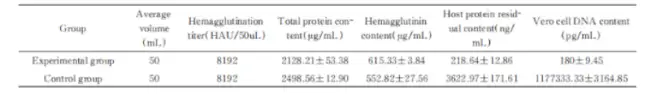
1.樣品:狂犬病毒濃縮液
處理條件:核酸酶濃度50~90U/ml ,
37 ℃處理 2 h,轉入18 ~ 26 ℃處理 6h
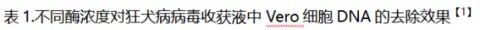
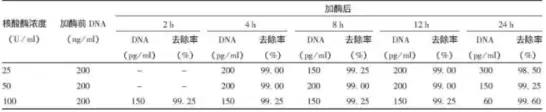
2.樣品:狂犬病病毒濃縮液
處理條件:25、50和100 U/ml,37℃

3.樣品:流感病毒濃縮液
處理條件:10 U/mL,37℃


 中級會員·6年
中級會員·6年
