聯(lián)系電話
- 聯(lián)系人:
- 曹女士
- 電話:
- 400-6111-883
- 手機(jī):
- 售后:
- 4006-111-883
- 傳真:
- 86-21-34615995
- 地址:
- 上海市浦東新區(qū)天雄路166弄1號(hào)3樓
- 網(wǎng)址:
- www.yeasen.com
掃一掃訪問手機(jī)商鋪
背景介紹
細(xì)胞和基因療法(Cell and Gene Therapy, CGT)是通過改變細(xì)胞原有基因的表達(dá)以達(dá)到治療疾病的方法,也即通過對(duì)人體細(xì)胞和基因進(jìn)行修復(fù)、替換和改造,直接從患者的疾病根源進(jìn)行治療,臨床應(yīng)用潛力巨大,有望成為未來新藥發(fā)展的主流方向之一。目前CGT治療領(lǐng)域以腫瘤和罕見病為主,逐漸向其他疾病領(lǐng)域拓展。根據(jù)Frost &Sullivan測(cè)算,全球CGT療法的市場(chǎng)規(guī)模有望在2025年達(dá)到305.4億美元,對(duì)應(yīng)2020-2025年CAGR高達(dá)71.2%。
CGT療法包括以免疫細(xì)胞治療、干細(xì)胞治療和其它體細(xì)胞治療為主的細(xì)胞療法,還包括以病毒為載體的基因替代和非病毒載體的基因編輯治療為主的基因療法。細(xì)胞與基因治療技術(shù)工藝路線主要包含三個(gè)方面:質(zhì)粒、病毒載體和細(xì)胞工廠,提升這三個(gè)方面的工藝開發(fā)技術(shù)、大規(guī)模生產(chǎn)能力,從而能夠更好地進(jìn)行質(zhì)量控制和成本控制。然而在CGT藥物從早期研發(fā)、到成功上市需要經(jīng)歷多個(gè)階段,每個(gè)階段都存在極其復(fù)雜的不確定性,需要對(duì)其中多個(gè)關(guān)鍵點(diǎn)進(jìn)行嚴(yán)格的質(zhì)量控制,從而確保最終產(chǎn)品的安全性和有效性。
圖1.CGT藥物研發(fā)及生產(chǎn)流程中翌圣質(zhì)控產(chǎn)品推薦
宿主細(xì)胞殘留DNA(HCD)檢測(cè)
去除宿主細(xì)胞雜質(zhì)是細(xì)胞基因治療藥物在內(nèi)的生物制藥產(chǎn)品生產(chǎn)中的關(guān)鍵步驟,其中宿主細(xì)胞殘留DNA由于可能存在的免疫原性、感染性以及致瘤性等安全問題成為關(guān)鍵質(zhì)控指標(biāo)。在此情況下,建立合適的檢測(cè)方法監(jiān)測(cè)生產(chǎn)工藝,控制宿主細(xì)胞殘留核酸限度,以確保產(chǎn)品的安全性和質(zhì)量已經(jīng)成為監(jiān)管機(jī)構(gòu)和行業(yè)內(nèi)關(guān)注的重點(diǎn)。
《中國(guó)藥典》2020年版三部規(guī)定,以細(xì)胞基質(zhì)生產(chǎn)的生物制劑外源宿主細(xì)胞DNA殘留量不能超過100pg/劑,以細(xì)菌或真菌基質(zhì)(酵母、大腸桿菌等)表達(dá)的生物制品中DNA殘留量不超過10ng/劑;
《歐洲藥典》(EP10.0)通則規(guī)定的生物制品殘留DNA限度大多為不超過10ng/劑;
美國(guó)食品藥品監(jiān)督管理局(FDA)發(fā)布的指導(dǎo)原則中指出生物制品宿主細(xì)胞DNA殘留限度不得超過100pg/劑,對(duì)于大劑量的生物制品(如單克隆抗體),根據(jù)其殘留DNA來源及給藥途徑,DNA殘留量可放寬至10ng/劑。
此外,《中華人民共和國(guó)藥典》2020年版第三部規(guī)定,外源性DNA殘留檢測(cè)采用DNA探針雜交法、熒光染色法和定量PCR法。目前市場(chǎng)上對(duì)宿主細(xì)胞殘留DNA檢測(cè),主要采用熒光探針qPCR方法,qPCR法具有高的靈敏度、序列特異性和準(zhǔn)確性,可為生物制藥工業(yè)在工藝研究和成品質(zhì)量控制方面提供可靠的檢測(cè)手段,現(xiàn)也已成為各生物制品廠家檢測(cè)方法。
翌圣生物自主研發(fā)的E.coli宿主細(xì)胞殘留DNA的qPCR法檢測(cè)試劑盒,可快速高效檢測(cè)生物藥中宿主DNA殘留量。還研發(fā)了與之配套使用的宿主細(xì)胞殘留DNA樣本前處理試劑盒,以及配套的自動(dòng)化核酸提取儀器。
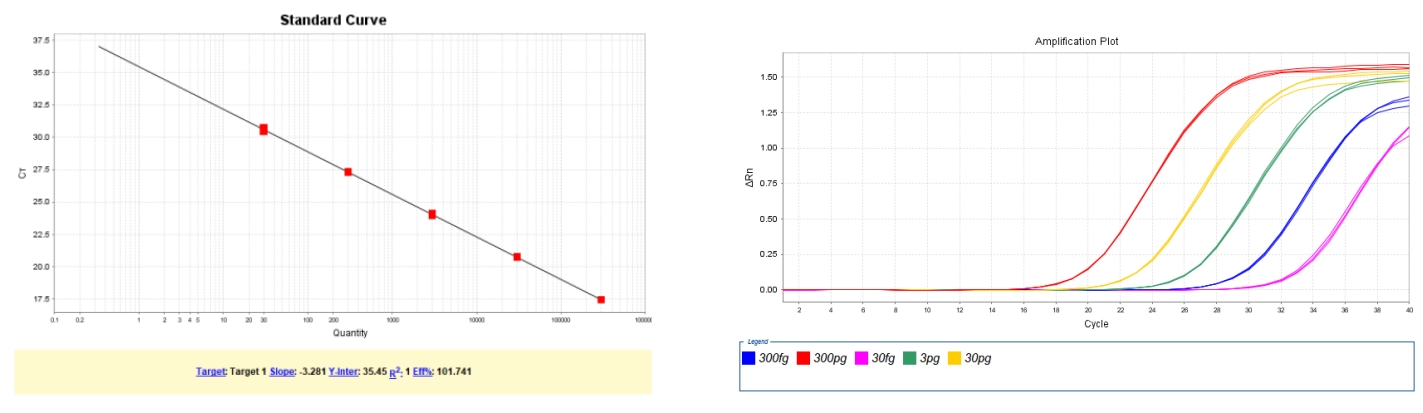
圖2. E.coli DNA (2G)標(biāo)曲范圍30fg/μL~300pg/μL,R2=1,擴(kuò)增效率為101.74%,各濃度檢測(cè)值CV<15%
宿主細(xì)胞殘留DNA片段分析
除需對(duì)DNA的殘留量進(jìn)行控制外,DNA殘留片段大小分布也是確定其相關(guān)風(fēng)險(xiǎn)因素的重要指標(biāo)。有研究表明,一個(gè)功能基因至少在200bp以上,因此大于200bp可能會(huì)有一定的致病性,且殘留DNA片段越大,生物制品的風(fēng)險(xiǎn)等級(jí)越高。
美國(guó)FDA在《Chemistry, Manufacturing, and Control (CMC) Information for Human Gene Therapy Investigational New Drug Applications (INDs)》的行業(yè)指南中建議將非致瘤性連續(xù)細(xì)胞的殘留DNA量限制在10 ng/劑以下,DNA大小限制在約200bp以下。
2022年5月,國(guó)家藥品監(jiān)督管理局藥品評(píng)審中心(CDE)發(fā)布的體內(nèi)基因治療產(chǎn)品要學(xué)研究與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)中也明確指出需對(duì)DNA殘留量和殘留片段大小進(jìn)行控制,建議盡量將DNA殘留片段的大小控制在200bp以下。
目前,行業(yè)內(nèi)對(duì)于殘留宿主細(xì)胞DNA片段分析,主要是利用毛細(xì)管電泳的方法。研究者們開發(fā)了一種基于毛細(xì)管凝膠電泳與敏感激光誘導(dǎo)熒光(CGE-LIF)檢測(cè)殘留DNA分子大小的方法,可以檢測(cè)生物制品中殘留DNA的大小,實(shí)驗(yàn)表明,大多數(shù)宿主細(xì)胞殘留DNA片段大小為50~2 000bp。除了毛細(xì)管電泳法外,實(shí)時(shí)熒光定量PCR(qPCR)法也被用于進(jìn)行生物制品中生產(chǎn)用細(xì)胞相關(guān)的DNA片段分布的分析。且qPCR法相比于CGE-LIF操作更簡(jiǎn)單,耗時(shí)更短。
針對(duì)上述情況,翌圣生物自主研發(fā)了E.coli&HEK293殘留DNA片段分析試劑盒,采用熒光探針qPCR法原理,設(shè)計(jì)了四種不同的擴(kuò)增片段(幾十bp、100多bp、200多bp、500多bp),用于定量檢測(cè)樣本中宿主細(xì)胞殘留DNA片段的大小分布情況。

圖3. 宿主細(xì)胞中殘留DNA片段分析檢測(cè)流程圖
宿主細(xì)胞殘留RNA(HCR)檢測(cè)
據(jù)了解,各監(jiān)管機(jī)構(gòu)在判定DNA產(chǎn)品純度時(shí),均會(huì)將宿主細(xì)胞殘留RNA(HCR)含量作為其中一項(xiàng)關(guān)鍵檢測(cè)指標(biāo)。
2022年5月,國(guó)家藥品監(jiān)督管理局藥品評(píng)審中心(CDE)發(fā)布的體內(nèi)基因治療產(chǎn)品要學(xué)研究與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)中也明確指出需對(duì)生產(chǎn)工藝引入的工藝相關(guān)雜質(zhì),如宿主細(xì)胞RNA等納入產(chǎn)品質(zhì)量標(biāo)準(zhǔn)進(jìn)行控制。
美國(guó)FDA中明確規(guī)定了質(zhì)粒材料的質(zhì)量標(biāo)準(zhǔn):超螺旋DNA>85%,宿主細(xì)胞蛋白<1%,殘留細(xì)菌DNA<1%(聚合酶鏈?zhǔn)椒磻?yīng)測(cè)定),殘留細(xì)菌RNA<1%(高效液相色譜法或凝膠法檢測(cè)不到)。
歐洲藥品管理局(EMA)在《基因治療藥物產(chǎn)品的質(zhì)量、非臨床和臨床方面的指導(dǎo)原則》中,提出應(yīng)考慮宿主細(xì)胞殘留RNA,以確定質(zhì)粒純度。
已知,對(duì)于生物制品的起始原材料質(zhì)粒DNA中的宿主菌RNA殘留檢測(cè),通常采用20年版中國(guó)藥典0541通則瓊脂糖凝膠電泳法。此外,USP發(fā)布的《mRNA疫苗質(zhì)量分析方法-指南草案》(第二版),對(duì)于質(zhì)粒DNA質(zhì)量屬性的測(cè)試中提到了:宿主細(xì)胞RNA檢測(cè)可采用高效液相色譜或瓊脂糖凝膠電泳法。
除了瓊脂糖凝膠電泳和高效液相色譜法外,行業(yè)內(nèi)還會(huì)采用定量逆轉(zhuǎn)錄PCR(RT-qPCR)和RNA熒光定量方法檢測(cè)生物制品中的宿主細(xì)胞殘留RNA。RT-qPCR法由于可實(shí)現(xiàn)對(duì)待測(cè)樣本中的殘留RNA專一性擴(kuò)增和精確定量,而被廣泛應(yīng)用。
翌圣生物自主研發(fā)的E.coli殘留RNA檢測(cè)試劑盒可專一快速檢測(cè)樣本中E.coli殘留RNA。
E.coli殘留RNA檢測(cè)Kit產(chǎn)品性能
檢測(cè)范圍寬:試劑盒線性范圍為2fg/uL~200pg/uL;
準(zhǔn)確度高:稀釋線性好,且樣本加標(biāo)回收率在80~120%之間;
靈敏度高:定量下限(LLOQ)分別為1fg/uL;
精密度高:批內(nèi)重復(fù)性高CV<10%,批間差異小即中間精密度CV<15%。
宿主細(xì)胞殘留蛋白(HCP)檢測(cè)
生物制品中HCP殘留含量通常被認(rèn)為是產(chǎn)品的關(guān)鍵質(zhì)量屬性(CQA),是工藝穩(wěn)健性監(jiān)測(cè)的重要評(píng)價(jià)指標(biāo),也是產(chǎn)品的重要質(zhì)控指標(biāo)。各國(guó)法規(guī)都有涉及HCP的論述,要求必須對(duì)生物藥品進(jìn)行分析和純化,以將宿主細(xì)胞蛋白HCP降低到可接受的水平。
《中國(guó)藥典》三部(2020版)規(guī)定:針對(duì)CHO細(xì)胞,HCP殘留需要<0.05%(相當(dāng)于小于500ppm);針對(duì)E.coli,HCP殘留需要<0.01%。
美國(guó)藥典USP<1132>章節(jié)規(guī)定:用一種靈敏度較高的方法檢測(cè)藥品中的HCP,其含量應(yīng)該低于檢測(cè)限(通常小于100ppm,即1mg總蛋白中HCP含量應(yīng)小于100ng,也即<0.01%)。
酶聯(lián)免疫吸附法(ELISA)是目前HCP檢測(cè)常用的方法,在2020版《中國(guó)藥典》通則3412/3413/3414中提到的宿主蛋白殘留檢測(cè)方法均為ELISA法。
翌圣生物科技(上海)股份有限公司自主研發(fā)了包括CHO宿主細(xì)胞在內(nèi)的多款HCP蛋白殘留量檢測(cè)試劑盒。試劑盒均采用雙抗夾心酶聯(lián)免疫檢測(cè)(ELISA)的實(shí)驗(yàn)原理,以及生物素-鏈霉親和素放大系統(tǒng),能夠高靈敏的檢測(cè)樣本中HCP殘留量。試劑盒可以用于生物制品純化工藝過程的優(yōu)化、中間工藝過程的雜質(zhì)控制以及終產(chǎn)品的放行檢測(cè)。
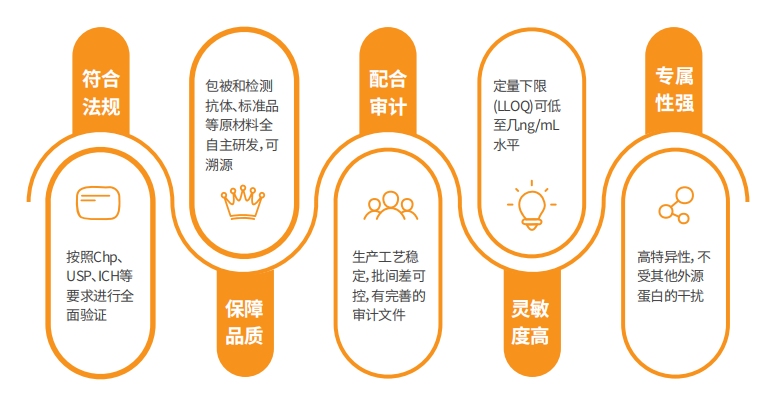
圖4. 翌圣HCP ELISA試劑盒產(chǎn)品特點(diǎn)
核酸酶殘留檢測(cè)
在治療性藥物(如抗體、病毒載體藥物等)的生產(chǎn)及工藝流程中,核酸雜質(zhì)的去除至關(guān)重要。UltraNuclease全能核酸酶,又稱為廣譜核酸酶、非限制性核酸內(nèi)切酶,其能夠在多種實(shí)驗(yàn)條件下切割和降解各種形式的DNA和RNA,廣泛用于去除生物制品中的核酸。
在正常的純化步驟中,全能核酸酶作為雜質(zhì)很容易被去除。為檢測(cè)全能核酸酶具體殘留量,行業(yè)內(nèi)常采用UltraNuclease作為標(biāo)準(zhǔn)品,開發(fā)與之配套的ELISA試劑盒。
翌圣自主研發(fā)的UCF.ME® UltraNuclease ELISA Kit正是采用雙抗體夾心酶聯(lián)免疫檢測(cè)(夾心ELISA)原理,能夠準(zhǔn)確檢測(cè)樣本中全能核酸酶的殘留量,該試劑盒在線性、重復(fù)性、回收率及特異性等方面均表現(xiàn)穩(wěn)定。
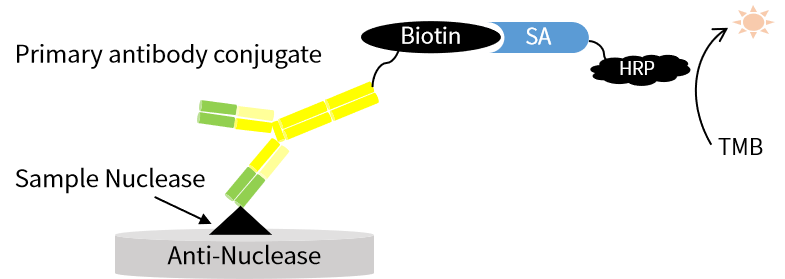
圖5. 翌圣核酸酶ELISA試劑盒實(shí)驗(yàn)原理(雙抗夾心ELISA法)
復(fù)制型病毒(RCL/RCR/rcAAV)檢測(cè)
大多數(shù)應(yīng)用于細(xì)胞基因治療的病毒載體均被設(shè)計(jì)為復(fù)制缺陷型。對(duì)于復(fù)制缺陷型病毒載體,在生產(chǎn)中可能發(fā)生經(jīng)缺失改造的載體與野生型病毒序列之間的同源重組,導(dǎo)致產(chǎn)生復(fù)制型病毒,其中包括復(fù)制型慢病毒(RCL)、復(fù)制型逆轉(zhuǎn)錄病毒(RCR)和復(fù)制型腺相關(guān)病毒(rcAAV)。終產(chǎn)品中復(fù)制型病毒的存在有可能引起病人不良反應(yīng),構(gòu)成臨床隱患和潛在危險(xiǎn),甚至引發(fā)腫瘤,故對(duì)復(fù)制型病毒檢測(cè)是安全性檢測(cè)中非常重要的項(xiàng)目。
隨著病毒載體在CGT領(lǐng)域應(yīng)用越來越廣泛,相關(guān)法規(guī)和技術(shù)原則對(duì)監(jiān)測(cè)復(fù)制型病毒提出了建議。
2022年CDE發(fā)布《體內(nèi)基因治療產(chǎn)品藥學(xué)研究與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)》和《體外基因修飾系統(tǒng)藥學(xué)研究與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)》都提到病毒載體制備工藝中,復(fù)制型病毒是安全性風(fēng)險(xiǎn)關(guān)注點(diǎn)之一,應(yīng)采用經(jīng)驗(yàn)證的方法開展檢測(cè),如指示細(xì)胞培養(yǎng)法、直接qPCR法等。
2020年1月28日,F(xiàn)DA發(fā)布的《關(guān)于細(xì)胞與基因治療申請(qǐng)(INDs)的化學(xué)、制造和控制(CMC)指導(dǎo)原則》中提到:對(duì)于生產(chǎn)過程中產(chǎn)生的RCA、RCR等,需要進(jìn)行病毒收獲液、病毒原液、制劑等的檢測(cè)。
針對(duì)上述情況,翌圣生物自主研發(fā)了一系列復(fù)制型病毒(RCL/RCR/RCA/rcAAV)檢測(cè)試劑盒,基于熒光探針定量PCR原理,采用qPCR法特異性擴(kuò)增對(duì)應(yīng)復(fù)制型病毒的序列,專一快速的檢測(cè)各種使用病毒載體相關(guān)的細(xì)胞基因治療產(chǎn)品中可能發(fā)生的復(fù)制型病毒的潛在風(fēng)險(xiǎn)。
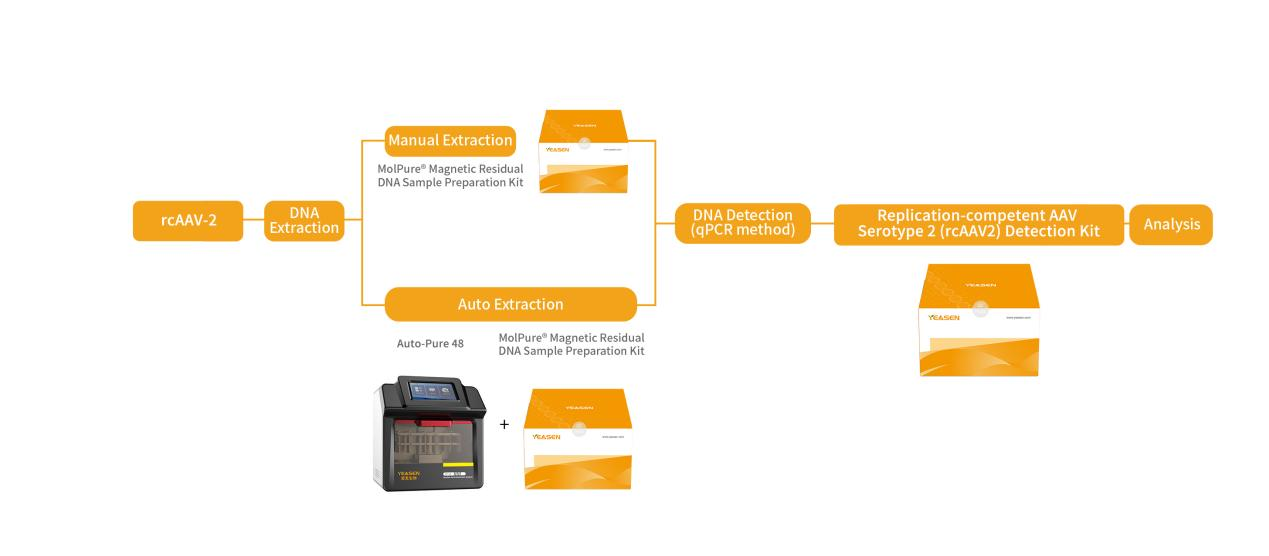
圖6.翌圣生物rcAAV-2復(fù)制型腺相關(guān)病毒檢測(cè)實(shí)驗(yàn)流程
CAR/TCR基因拷貝數(shù)檢測(cè)試劑盒
已知CAR-T和TCR-T細(xì)胞治療,均是將含有CAR或TCRαβ序列的目的基因構(gòu)建到慢病毒或逆轉(zhuǎn)錄病毒載體中,然后進(jìn)行病毒感染T細(xì)胞,獲得CAR-T或TCR-T細(xì)胞。這些載體基因整合在T細(xì)胞基因組中,一方面顯示有T細(xì)胞進(jìn)行了CAR或TCR基因修飾,一方面又是一個(gè)安全性指標(biāo),可能會(huì)因整合而帶來原癌基因的激活或抑癌基因的失活等造成二次腫瘤的風(fēng)險(xiǎn)。盡管現(xiàn)在載體的設(shè)計(jì)已經(jīng)大大降低了整合的風(fēng)險(xiǎn),但這種風(fēng)險(xiǎn)仍未全消除,因此需要對(duì)整合到細(xì)胞基因組中的病毒載體拷貝數(shù)進(jìn)行檢測(cè)。
針對(duì)CAR和TCR基因整合帶來的潛在風(fēng)險(xiǎn),國(guó)內(nèi)外的藥品監(jiān)管相關(guān)機(jī)構(gòu)都發(fā)布了相應(yīng)的指導(dǎo)性文件。
2018年6月,中國(guó)食品藥品檢定研究院頒發(fā)的《CAR-T細(xì)胞治療產(chǎn)品質(zhì)量控制檢測(cè)研究及非臨床研究考慮要點(diǎn)》明確規(guī)定CAR基因拷貝數(shù)≤5 copies/細(xì)胞。
目前,實(shí)時(shí)熒光定量PCR(qPCR)廣泛用于基因表達(dá)、拷貝數(shù)確定和病原體檢測(cè)研究等,這種方法可以準(zhǔn)確定量樣品中DNA或RNA的核酸靶序列數(shù)量。因此,CAR和TCR等轉(zhuǎn)基因拷貝數(shù)的檢測(cè)行業(yè)內(nèi)也普遍采用qPCR的方法。
翌圣生物自主研發(fā)了CAR/TCR基因拷貝數(shù)檢測(cè)試劑盒,采用多重?zé)晒馓结榪PCR法分別檢測(cè)CAR-T或TCR-T細(xì)胞基因組中CAR或TCR基因的拷貝數(shù)以及人體細(xì)胞中單拷貝基因(Single Copy Gene, SCG)。
CAR/TCR基因拷貝數(shù)檢測(cè)Kit產(chǎn)品性能
符合法規(guī):按照法規(guī)要求進(jìn)行全面驗(yàn)證,可提供驗(yàn)證報(bào)告;
保障品質(zhì):試劑盒原材料全自主研發(fā),qPCR Mix等酶產(chǎn)品在超潔凈酶工廠生產(chǎn);
靈敏度高:定量限可達(dá)21copies/μL,檢測(cè)限1.05copies/μL;
精密度高:批內(nèi)重復(fù)性高,批間差異小;
專屬性強(qiáng):特異性檢測(cè)CAR或TCR基因拷貝數(shù),不受其他外源基因組DNA干擾;
防干擾強(qiáng):添加內(nèi)部對(duì)照(IC),便于排除樣本干擾、反應(yīng)配制異常等因素
支原體檢測(cè)
相較于傳統(tǒng)化學(xué)藥物,以基因治療、細(xì)胞治療或組織工程為基礎(chǔ)的新型生物治療業(yè)已成為前沿性治療藥物。這些藥物大多以細(xì)胞為載體制備或構(gòu)建,因此,在此過程中,對(duì)于細(xì)胞種子庫(kù)、病毒培養(yǎng)和收獲、臨床治療用途的細(xì)胞等生物制品中生產(chǎn)制備過程易受到支原體污染。
支原體是一種比較常見但通常難以去除的污染類型,對(duì)于涉及細(xì)胞培養(yǎng)的生物制品工藝過程,法規(guī)要求“必須確保無支原體污染"。目前國(guó)內(nèi)外藥典推薦的支原體檢測(cè)方法主要是基于培養(yǎng)法、NAT(核酸擴(kuò)增法)法、細(xì)胞培養(yǎng)指示法。
翌圣生物MycAway®支原體qPCR檢測(cè)試劑盒(探針法)(2G)是基于NAT法的一種快速定性檢測(cè)生產(chǎn)原料、細(xì)胞庫(kù)、病毒種子、病毒或細(xì)胞收獲液、治療用細(xì)胞中潛在支原體污染的產(chǎn)品。該試劑盒基于定量PCR技術(shù),使用Taqman熒光探針定性檢測(cè)待測(cè)樣本中支原體DNA,可覆蓋183種支原體DNA序列;并且嚴(yán)格按照EP 2.6.7和JP G3支原體檢測(cè)相關(guān)指南和要求進(jìn)行驗(yàn)證,具備靈敏度高、特異性好、安全性好等特點(diǎn)。該試劑盒還能夠與MolPure®磁珠法殘留DNA樣本前處理試劑盒搭配使用,通過手動(dòng)提取或者使用自動(dòng)化核酸提取儀自動(dòng)提取樣本核酸,再由qPCR收集探針的熒光信號(hào),從而對(duì)檢測(cè)結(jié)果進(jìn)行判定。
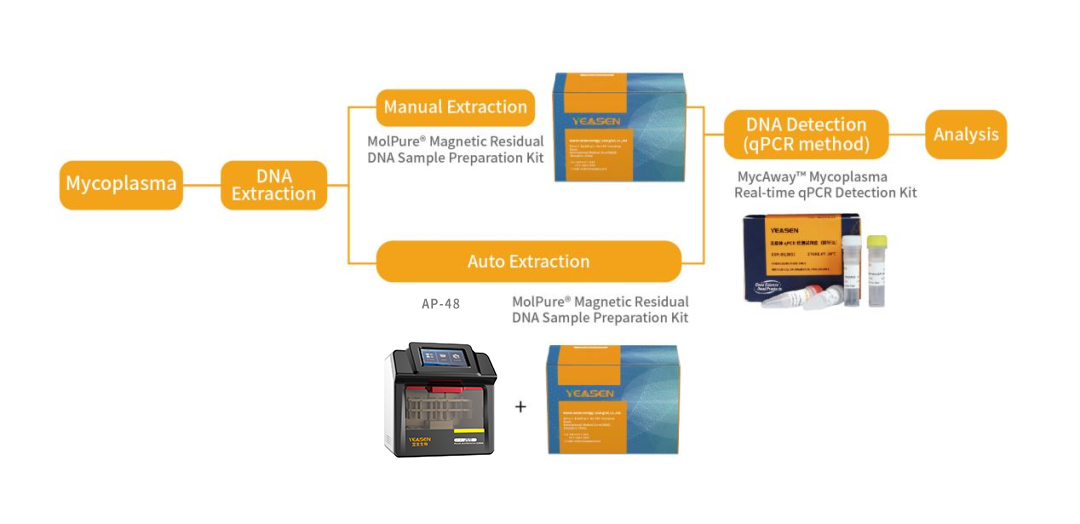
圖7.翌圣生物NAT法支原體qPCR檢測(cè)實(shí)驗(yàn)流程
產(chǎn)品信息
類別 | 產(chǎn)品 | 貨號(hào) | 品名 | 規(guī)格 |
宿主細(xì)胞 殘留核酸檢測(cè) | 樣本前處理 試劑盒 | 18461ES | MolPure® Magnetic Residual DNA Sample Preparation Kit 磁珠法殘留DNA樣本前處理試劑盒(瓶裝) | 25T/100T |
18467ES | MolPure® Mag48 Sample Preparation Kit FN 磁珠法48孔樣本前處理試劑盒FN(預(yù)封裝) | 3×16T/ 6×16T | ||
核酸提取儀器 | 80511ES | 48通道自動(dòng)化核酸提取儀 | 48通量 | |
殘留DNA試劑盒 |
41308ES | E.coli Host Cell DNA Residue Detection Kit (2G) E.coli宿主細(xì)胞DNA殘留檢測(cè)試劑盒(2G) | 50T/100T | |
41331ES | HEK293 Host Cell DNA Residue Detection Kit (3G) HEK293宿主細(xì)胞DNA殘留檢測(cè)試劑盒(3G) | 50T/100T | ||
41310ES | SV40LTA&E1A Residue DNA Detection Kit SV40LTA&E1A殘留DNA檢測(cè)試劑盒 | 50T/100T | ||
41323ES | Plasmid DNA Residue Detection Kit 質(zhì)粒DNA殘留檢測(cè)試劑盒 | 50T/100T | ||
41330ES | Sf9 and Baculovirus DNA Residue Detection Kit Sf9和桿狀病毒DNA殘留檢測(cè)試劑盒 | 50T/100T | ||
片段分析試劑盒 |
41337ES | E.coli Host Cell Residue DNA Size Analysis Kit E.coli 宿主細(xì)胞殘留DNA片段分析試劑盒 | 4×50T/ 4×100T | |
41316ES | HEK293 Host Cell Residue DNA Size Analysis Kit HEK293宿主細(xì)胞殘留DNA片段分析試劑盒 | 4×50T/ 4×100T | ||
殘留RNA試劑盒 |
41318ES | E.coli Host Cell RNA Residue Detection Kit E.coli宿主細(xì)胞RNA殘留檢測(cè)試劑盒 | 50T/100T | |
宿主細(xì)胞 殘留蛋白檢測(cè) |
HCP試劑盒 | 36712ES | E.coli HCP ELISA kit E.coli HCP ELISA檢測(cè)試劑盒 | 48T/96T |
36721ES | E.coli HCP ELISA Kit (Plasmid) E.coli HCP ELISA檢測(cè)試劑盒(質(zhì)粒) | 48T/96T | ||
36713ES | HEK293 HCP ELISA kit HEK293 HCP ELISA檢測(cè)試劑盒 | 48T/96T | ||
核酸酶 殘留檢測(cè) |
核酸酶ELISA 試劑盒 | 36701ES | UCF.ME® UltraNuclease ELISA Kit 全能核酸酶檢測(cè)試劑盒 | 96T |
36703ES | Salt Active UltraNuclease ELISA kit 耐高鹽全能核酸酶ELISA試劑盒 | 48T/96T | ||
復(fù)制型病毒檢測(cè) |
復(fù)制型病毒qPCR試劑盒 | 41311ES | Replication-competent Lentivirus (RCL) Detection Kit 復(fù)制型慢病毒(RCL)檢測(cè)試劑盒 | 50T/100T |
41321ES | RCA (E1A) Copynumber Detection Kit RCA (E1A)基因拷貝數(shù)檢測(cè)試劑盒 | 50T/100T | ||
41327ES | Replication-competent AAV Serotype 2 (rcAAV2) Detection Kit 復(fù)制型腺相關(guān)病毒血清型2(rcAAV2)檢測(cè)試劑盒 | 50T/100T | ||
41329ES | Replication-competent Lentivirus (RCR) Detection Kit 復(fù)制型逆轉(zhuǎn)錄病毒(RCR)檢測(cè)試劑盒 | 50T/100T | ||
CAR拷貝數(shù)檢測(cè) | CAR拷貝數(shù)qPCR試劑盒 | 41313ES | CAR/TCR Copynumber Detection Kit CAR/TCR基因拷貝數(shù)檢測(cè)試劑盒 | 50T/100T |
慢病毒滴度檢測(cè) |
慢病毒滴度ELISA&qPCR 試劑盒 | 41333ES | Lentivirus Physical Titer qPCR Detection Kit 慢病毒物理滴度qPCR檢測(cè)試劑盒 | 50T/100T |
99301ES | HIV-1 p24 ELISA Kit 慢病毒(p24 抗原)檢測(cè)試劑 | 24T/48T/96T | ||
支原體檢測(cè) |
支原體qPCR 試劑盒 | 40619ES | MycAway® Mycoplasma Real-time qPCR Detection Kit (2G) 支原體qPCR檢測(cè)試劑盒(探針法)(2G) | 25T/100T |

 初級(jí)會(huì)員·13年
初級(jí)會(huì)員·13年
