T7 High Yield RNA Synthesis Kit
產品貨號 :T0126
儲存條件: -20℃ 保存,有效期2年
產品描述
組分 | 規格 (50 rxns) |
T7 Enzyme Mix | 100 μl |
10× T7 Transcription Bu?er | 100 μl |
ATP (100mM) | 100 μl |
UTP (100mM) | 100 μl |
GTP (100mM) | 100 μl |
CTP (100mM) | 100 μl |
Control Template (0.5μg/μl) | 10 μl |
DNase I, RNase-free (1U/μl) | 100 μl |
Nuclease-Free Water | 1 ml |
產品簡介
T7 High Yield RNA Synthesis Kit是一種使用T7 RNA聚合酶,以帶有T7啟動子的DNA為模板,通過體外轉錄大量合成RNA的試劑盒,適用于長鏈和短鏈轉錄本。本品提供的T7 Enzyme Mix中已經預混了RNase抑制劑與無機焦磷酸酶,而DNase I,RNase-free用于轉錄反應結束后清除模板DNA。使用本品以1μg線性化雙鏈DNA模板可以轉錄獲得至少150μg以上的RNA。通過轉錄合成的RNA可用于多種下游應用,如體外翻譯、RNA結構和功能研究、RNase保護、探針雜交、RNA干擾等。
轉錄方案
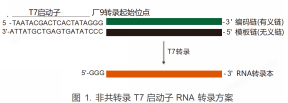
使用方法
1. DNA 模板制備
帶有 T7 啟動子的線性化質粒或 PCR 擴增產物都可以作為體外轉錄模板,模板可以用TE緩沖液或Nuclease-Free Water溶解。
T7啟動子序列:TAATACGACTCACTATAN*
注:N*為RNA轉錄的第一個堿基,一般為G,若進行共轉錄由帽子類似物決定。
(1)質粒模板
將目的DNA插入含有T7啟動子的質粒載體中,然后用限制酶進行處理,待完quan線性化后進行純化。
注1:由于終止子不能保證轉錄100%終止,環狀質粒會轉錄出不同長度的RNA產物。為了得到特定長度的RNA,質粒必須完quan線性化。
注2:質粒線性化所選限制酶的酶切位點需要緊鄰編碼鏈下游,且在編碼鏈中無識別位點。選擇的限制酶要能形成5'突出末端或者平滑末端。
注3:為了避免蛋白及鹽離子等對轉錄體系的影響,線性化質粒建議純化后再作為模板進行體外轉錄。
注4:質粒DNA抽提過程中引入的RNaseA殘留會顯著影響轉錄RNA的質量,建議使用A260/A280為1.8~2.0的高純度RNase-free模板。
(2)PCR 產物模板
帶 T7 啟動子的 PCR 產物可以作為體外轉錄模板。首先將 T7 啟動 子序列加在編碼鏈上游引物的 5' 端,然后在高保真酶的作用下擴增含 T7 啟動子的 DNA模板,隨后進行轉錄。 PCR 產物可以不經純化直接作為模板, 但純化后 RNA 收率會更高。
注 1:PCR 產物作為模板,必須電泳確認產物的特異性及濃度,建議 20 μl 反應體系投入 2~5 μl PCR 產物。
注 2:為了得到更多高品質的 RNA,推薦 PCR 產物純化之后再作為模板進行體外轉錄。
2. 體外轉錄
(1)根據所需產物類型選擇下面三個反應體系進行反應溶液加樣。
①標準體外轉錄體系
在冰上配制如下反應體系:
試劑 | 體積 | 終濃度 |
10× T7 Transcription Bu?er | 2 μl | 1× |
T7 Enzyme Mix | 2 μl | - |
Template DNA | 1 μg | 50 ng/μl |
ATP/CTP/GTP/UTP(100mM each)a,b | 2 μl each | 10 mM each |
Nuclease-Free Water | up to 20 μl | - |
a. 建議先加入Nuclease-Free Water, 然后再加入 ATP/CTP/GTP/UTP。
b. 可以用同樣摩爾濃度的修飾 NTP 替代相應的未修飾 NTP。
②加帽 RNA 共轉錄體系
在冰上配制如下反應體系:
試劑 | 體積 | 終濃度 |
10× T7 Transcription Bu?er | 2 μl | 1× |
T7 Enzyme Mix | 2 μl | - |
Template DNA | 1 μg | 50 ng/μl |
ATP/CTP/GTP/UTP (100mM each) Cap1 Analogue (100 mM)c Nuclease-Free Water | 2μl each 1.6μl up to 20 μl | 10 mM each |
8 mM | ||
- |
c. 帽子類似物與每種 NTP 的摩爾濃度之比應為 4 : 5,該摩爾比適用于 CleanCap 系列帽子類似物。若使用其它結構的帽子類似物,請根據帽子類似物的說明書設定帽子類似物與 GTP 的合理比例,可根據加帽效率調整比例,但兩者終濃度之和控制在 10 mM 為宜。
③非放射性標記 RNA 體外轉錄體系
試劑 | 體積 | 終濃度 |
10× T7 Transcription Bu?er | 2 μl | 1× |
T7 Enzyme Mix | 2 μl | - |
Template DNA | 1 μg | 50 ng/μl |
ATP/CTP/GTP (100 mM each) | 2 μl each | 10 mM each |
UTP (100 mM) | 1.5 μl | 7.5 mM |
修飾 UTP (50 mM)d Nuclease-Free Water | 1 μl up to 20 μl | 2.5 mM |
- |
d. 本體系適用生wu素修飾 UTP、熒光素修飾 UTP、地gao辛修飾 UTP 或者氨基烯丙 基修飾 UTP,使用修飾 UTP 轉錄產量會比未修飾 UTP 轉錄產量偏低。
注 1:不同模板序列的轉錄效率差異較大,初次實驗可先按照建議加入量進行,然 后再摸索優化最適體系,模板量可在 0.5 μg~2 μg的范圍進行調整。
(2)充分混勻并瞬離后,37℃溫育 2 h。若轉錄產物長度<100 nt,可 延長反應時間至 3~16 h。
(3)反應結束后,向產物中按照每 μg Template DNA 加入 2 μl DNase I, RNase-free 的比例,37℃孵育 15 min 以去除 DNA 模板。
(4)轉錄后的 RNA 推薦用磁珠或者柱純化,也可以采用酚/氯仿或者氯化鋰純化。純化后的 RNA 可以進行下游實驗或者儲存于 -80℃備用。
3. 對照模板轉錄(T 包裝不含)
對照模板是一個含有T7啟動子的線性 DNA 片段,轉錄產物大小 約 4000 nt。在推薦的標準體外轉錄反應體系中,1μg 對照模板 DNA 在 37℃下反應 2h至少可獲得150μg以上的 RNA。
4. 產物純化
轉錄后的 RNA 可以選用磁珠法進行純化,也可以采用柱純化、酚 / 氯仿純化法或氯化鋰沉淀法等,以去除蛋白、游離的核苷酸。純化后的 RNA 經電泳檢測后可進行下游實驗或存儲于 -80℃。
(1) 磁珠純化法
按照磁珠說明書進行純化操作。
(2) 柱純化法
純化前加入80μl Nuclease-Free Water 將產物稀釋至 100 μl,再按純化柱說明書進行純化操作。
(3) 酚 / 氯仿純化法
①向 20 μl 反應混合物中,加入 115 μl Nuclease-Free Water 和 15 μl 3 M 乙酸鈉 (pH5.2),混合均勻。
②加入等體積 (150 μl) 的酚 / 氯仿 (1:1) 混合液抽提一次,室溫以最大轉 速 (≥12000 rpm) 離心 5 min,將上層水相溶液轉移至新的 RNase-free EP 管中。
注:轉移上清時請勿吸到中間層。
③再加入等體積的氯仿抽提 2 次,收集上清,并轉移至新的 RNase-free EP 管中。
④加入 2 倍體積的無水乙醇沉淀 RNA。混合均勻后置于 -20℃至少 30 min,以最大轉速(≥12000 rpm),4℃離心 15 min,收集沉淀。
⑤加入 500 μl 冰預冷的 70% 乙醇洗滌 RNA 沉淀,以最大轉速 (≥12000 rpm) , 4℃離心 5 min ,收集沉淀。
⑥用 20 μl Nuclease-Free Water溶解RNA 沉淀。純化后的 RNA 溶液于 -80℃保存。
(4) 氯化鋰沉淀法
采用氯化鋰沉淀法,RNA 長度至少滿足 100 nt 以上,且濃度不能低 于 100 ng/μl。
①向 20 μl 反應混合物中,加入 30 μl Nuclease-Free Water 和 30 μl 7.5 M 氯化鋰。
②混合均勻后,置于 -20℃至少 30 min,以最大轉速 (≥12000 rpm),4℃ 離心 15 min,收集沉淀。
③加入 500 μl 冰預冷的 70% 乙醇洗滌 RNA 沉淀,以
最大轉速 (≥12000 rpm),4℃離心 5 min,收集沉淀。
④用 20 μl Nuclease-Free Water 溶解 RNA 沉淀。純化后的 RNA 溶液 于 -80℃保存。
5. RNA 定量
(1) 紫外吸收法:游離的 NTP 等會嚴重影響定量的準確性,采用此方法 前請*行 RNA 純化。
(2) 染料法:可使用 RNA 特異熒光染料或相關試劑盒進行 RNA 定量,可 以對純化或者未純化的反應產物中的 RNA 進行定量。
6. RNA 檢測
(1) 凝膠電泳法
為了評估轉錄本的長度及質量,轉錄產物應選擇合適的非變性或變 性瓊脂糖或聚丙烯酰胺凝膠上進行電泳檢測。變性電泳下可減少 RNA 的 二級結構形成 , 通常 RNA 以正確大小的單個條帶遷移。
轉錄本長度 | 推薦使用電泳凝膠 |
>500 nt | 1% 瓊脂糖凝膠 |
100~500 nt | 2% 瓊脂糖凝膠或 4~5% 尿素變性聚丙烯酰胺凝膠 |
50~100 nt | 10%~15% 尿素變性聚丙烯酰胺凝膠 |
<50 nt | 20% 尿素變性聚丙烯酰胺凝膠 |
注 1:電泳緩沖液和凝膠均需現配現用,使用尿素變性聚丙烯酰胺凝膠電泳時推薦 用 0.5× TBE(貨號:T7272)電泳緩沖液電泳。
注 2:轉錄完成的 RNA 可用 Nuclease-Free Water 稀釋后電泳,電泳上樣量推薦 0.05~1 μg。
注 3:加完 RNA Loading Bu?er 后的樣品可于 65℃處理 5~10 min 以減少RNA二級結構形成。
注 4:可使用 Safe Red 核酸染料 ( 貨號:CR001) 觀察 RNA 電泳條帶,聚丙烯 凝膠酰胺凝膠推薦用泡染法觀察條帶。
(2) 毛細管電泳法
毛細管電泳法可數字化的精確評估 RNA 樣本的完整性、純度或降解 程度。與凝膠法相比,此法所需 RNA 樣本量低,靈敏度高。
常見問題
問題描述 | 原因 | 解決方法 |
轉錄產物產量低 | 實驗模板中可能有抑制反應的組分或模板純度較差或模 板濃度不正確 | 若對照組產量正常,請重新純化模板并確定模板濃度及其特異性。 若對照組產量低,請咨詢本公司技術支持。 |
短片段轉錄產物產量低 | 轉錄起始片段短可能會抑制反應 | 轉錄產物 100 nt 時,建議延長反應時間或者增加模板量至 2 μg。 |
RNA 產物片段小于預期 | 模板序列中可能包含類似于 T7 RNA 聚合酶的終止序列 | 建議降低反應溫度至 30℃可能會增加全長轉錄本的比例,但是產量會下降。 |
可能模板中 GC 含量高或形成二級結構 | 建議提高反應溫度至 42℃或使用單鏈結合蛋白提高產量和長度。 | |
RNA 產物片段大于預期 | 質粒模板 DNA 可能酶切不完quan | 建議質粒模板 DNA 繼續進行酶切或者重新優化質粒模板 DNA 制備酶切反應體系。 |
RNA 可能存在更強的二級結構而未完quan變性 | 增加變性劑的濃度或加完 RNA Loading Bu?er 后樣品變性溫度可提高至 70℃。 | |
電泳拖尾 | 實驗過程可能污染 RNase | 建議單獨的轉錄反應操作區域、專用的 RNA 試劑及移液器;實驗過程中佩戴口罩 和手套,并經常更換手套;使用 RNase-free 耗材;試劑不使用時請蓋好蓋子;反 應過程中保證試管緊密封閉。 |
模板可能有 RNase 污染 | 模板存在 RNase 污染也可能造成 RNA 產物片段小于預期,建議重新純化模板 DNA 后用 Nuclease-Free Water 或 DEPC 處理水溶解。 |
北京蘭博利德商貿有限公司
- 動物細胞IP試劑盒(Protein A/G agaros
- KTA4003-線粒體活性染色試劑盒
- CheKine™ 肌酸含量檢測試劑盒(
- KTB1412-總膽'紅'素(TBIL)含量檢測試
- 直接膽'紅'素(DBIL)含量檢測試劑盒
- 總膽汁酸(TBA)含量檢測試劑盒(微量
- PRP1956-重組人'表皮生長因子(EGF)
- PRP1957-重組小鼠表皮生長因子(EGF)
- 賽默飛Lipofectamine 2000轉染試劑1166
- 賽默飛Lipofectamine 3000轉染試劑L300
- 賽默飛Lipofectamine 3000轉染試劑L300
- 賽默飛Lipofectamine 2000轉染試劑1166








 采購中心
采購中心